题目内容
14.某学生课外兴趣小组为了测定镁铝合金中铝的含量,进行了如下实验.将合金3.0克投入到足量的100mL 1.5mol•L-1的烧碱溶液中,充分反应后分离出未反应的镁,然后在溶液中滴加1.0mol•L-1的盐酸,加入盐酸的体积与得到沉淀的数据如表:| 实验次数 | 加入盐酸的体积 | 沉淀质量 |
| 1 | 60mL | 0 |
| 2 | 80mL | 0.78g |
| 3 | 180mL | 5.46g |
(2)合金中铝的质量分数为72%.
分析 (1)开始沉淀时加入盐酸的体积必须大于中和过量烧碱消耗的盐酸的体积;加入的盐酸先中和过量烧碱,然后与偏铝酸钠反应生成氢氧化铝沉淀,当与偏铝酸钠反应的盐酸和与铝反应消耗的烧碱的物质的量相等时沉淀最大,根据表中数据可知,前60ml盐酸是中和过量的氢氧化钠的.0.78g沉淀是0.01mol,所以根据方程式H++AlO2-+H2O═Al(OH)3↓可知需要盐酸是0.01mol,其体积是10ml,得到开始沉淀时加入的盐酸体积,当沉淀最大时,溶液中氯元素守恒计算;
(2)生成的氢氧化铝是(0.15L-0.07L)×1.0mol/L=0.08mol,则铝的质量是0.08mol×27g/mol=2.16g,计算其质量分数;
解答 解:(1)根据实验次数2中数据计算,加入盐酸中氢离子的物质的量为1.0mol/L×0.08L=0.08mol,生成0.78g氢氧化铝的物质的量为0.01mol,由AlO2-+H++H2O=Al(OH)3↓可知,消耗氢离子0.01mol,则其余的0.07mol氢离子用于中和0.07mol的过量氢氧化钠,因此刚开始生成沉淀时加入的盐酸的体积必须大于70ml,根据实验次数2中数据计算,加入盐酸中氢离子的物质的量为1.0mol/L×0.08L=0.08mol,生成0.78g氢氧化铝的物质的量为0.01mol,由AlO2-+H++H2O=
Al(OH)3↓可知,消耗氢离子0.01mol,则其余的0.07mol氢离子用于中和0.07mol的过量氢氧化钠,因此刚开始生成沉淀时加入的盐酸的体积必须大于70ml;与合金中铝反应的氢氧化钠的物质的量为0.1L×1.5mol/L-0.07mol=0.08mol,当与偏铝酸钠反应的盐酸和与铝反应消耗的烧碱的物质的量相等时沉淀最大,因此若得到沉淀的量最大时,加入的盐酸的体积为70ml+80ml=150ml,
故答案为:70,150;
(2)生成的氢氧化铝是(0.15L-0.07L)×1.0mol/L=0.08mol,则铝的质量是0.08mol×27g/mol=2.16g,其质量分数为$\frac{2.16}{3.0}×100%=72%$,
故答案为:72%.
点评 本题考查了Al及其重要化合物的性质、计算,难度中等,把握加入的盐酸先中和过量烧碱,然后与偏铝酸钠反应生成氢氧化铝沉淀,当与偏铝酸钠反应的盐酸和与铝反应消耗的烧碱的物质的量相等时沉淀最大是解题的关键.

 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于碱式滴定管(填仪器名称)中滴加.
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是生成白色沉淀并逐渐增多.
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,同学们做出如下推测,请补充推测2和推测3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2:生成Al(OH)3沉淀消耗OH-
推测3:Al(OH)3沉淀溶解,消耗OH-
若推测1符合实际情况,则a点之前反应的离子方程式为Al3++3OH-═Al(OH)3↓,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异Al(OH)3比Mg(OH)2更难溶于水.
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
| 较大量存在的含金属元素的离子 | 检验方法 |
| Na+ | 用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+ |
| [Al(OH)4]- | 取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解 |
| 空 | 空 |
| A. | 反应中KBrO3得电子作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量比为5:8 | |
| C. | 根据上述反应可推知,还原性:AsH3>Br2 | |
| D. | 0.2 mol KBrO3参加反应电子转移1 mol |
[提出猜想]
Ⅰ.所得气体的成分可能只含 SO3一种;
Ⅱ.所得气体的成分可能含有SO2、O2 二种;(填分子式)
Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.
[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.
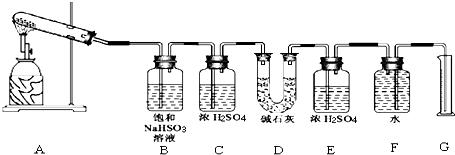
[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
(1)若实验结束时,G中量筒没有收集到水,则证明猜想Ⅰ 正确.(填Ⅰ或Ⅱ或Ⅲ)
(2)若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由:不能,因为SO3与B中的饱和NaHSO3反应会生成等物质的量的SO2.
(3)该实验设计中,容易给测定带来较大误差的因素有排水量气法测定气体的体积时量筒和广口瓶中液面变化和压强变化对液体体积的读数会产生误差.
(写出一种即可)
(4)经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
| 实验小组 | 称取CaSO4 的质量(g) | 装置D增加 的质量(g) | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
| 一 | 4.08 | 2.56 | 224 |
| 二 | 5.44 | 2.56 | 448 |
第二组:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑.
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{{c({C{H_3}CO{O^-}})}}{{c({C{H_3}COOH})}}$的值增大到原来的10倍 | |
| C. | pH相等的①NH4Cl ②(NH4)2SO4③NH4HSO4溶液中:c(NH4+)大小顺序:①>③>② | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
 某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )
某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )| A. | 电子由X极通过外电路移向Y极 | |
| B. | 电池工作时,Li+通过离子导体移向b区 | |
| C. | 负极发生的反应为:2H++2e-═H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
| A. | 按系统命名法,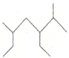 的名称为2-甲基-3,5-二乙基己烷 的名称为2-甲基-3,5-二乙基己烷 | |
| B. | 用Na2C03溶液能区分CH3CO0H、CH3CH2OH、苯和硝基苯四种物质 | |
| C. | 等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所消耗氧气的量依次增加 | |
| D. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 |
