题目内容
8.分子中碳与氢两元素的质量比为24:5的烃的一氯代物共有( )| A. | 4种 | B. | 3种 | C. | 6种 | D. | 5种 |
分析 先根据烃分子中碳、氢两种元素质量比为24:5,碳、氢两种元素个数比为2:5,最简式为C2H5,分子式为C4H10,然后根据氢原子的种类确定一氯代物的数目.
解答 解:该烃的结构简式为C4H10,丁烷有2种同分异构体:正丁烷和异丁烷,正丁烷有2种氢原子,异丁烷有2种氢原子,所以一氯代物的数目为4种,故选A.
点评 本题考查了同分异构体的判断,难度较大,先确定烃的结构简式,再确定等效氢原子,最后根据氢原子的种类确定一氯代物的种类.

练习册系列答案
相关题目
18.有关下列实验各装置图的叙述,不正确的是( )
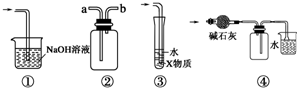

| A. | 装置①可用于吸收实验中多余的Cl2 | |
| B. | 装置②可用于收集H2、NH3、Cl2、HCl、NO2等 | |
| C. | 装置③中X为苯,可用于吸收氨气或氯化氢 | |
| D. | 装置④中可用于收集氨气,并吸收多余的氨气 |
19.X、Y、Z、R、W是原子序数依次增大的短周期主族元素,X与Z同主族,X的原子半径最小,Y与R 同主族,Y最外层电子数是电子层数的3倍.下列叙述正确的是( )
| A. | 原子半径:W>R>Z | B. | 最高价氧化物对应水化物酸性:R>W | ||
| C. | X与W形成的是离子化合物 | D. | 气态氢化物的热稳定性:Y>R |
16.短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )
| A. | 元素非金属性由强到弱的顺序:Y、X、W | |
| B. | W的简单气态氢化物比Y的简单气态氢化物稳定 | |
| C. | 原子半径由大到小的顺序:Z、Y、X、W | |
| D. | WX与ZX中的化学键类型相同 |
3.在所给条件下下列各组离子能够大量共存的是( )
| A. | pH=0的无色溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| B. | 使甲基橙变红的溶液中:Na+、HCO3-、Cl-、NO3- | |
| C. | 在有大量MnO4-溶液中:K+、Fe2+、SO42-、Cl- | |
| D. | 投入Al有氢所放出的溶液中:Na+、Cl-、K+、SO42- |
20.下列说法正确的是( )
| A. | 常温下,pH=11的NaOH和pH=11的KCN溶液中,水的电离程度相等 | |
| B. | 常温下,往Fe(OH)3悬浊液中分别加入少量NaClO、NH4Cl溶液,的溶解度都增大 | |
| C. | NH4Fe(SO4)2溶液中离子浓度关系:2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+) | |
| D. | 10mL0.1mol•L-1CHCOONa溶液与6mL0.2mol•L-1盐酸混合后:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
4. 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于碱式滴定管(填仪器名称)中滴加.
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是生成白色沉淀并逐渐增多.
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,同学们做出如下推测,请补充推测2和推测3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2:生成Al(OH)3沉淀消耗OH-
推测3:Al(OH)3沉淀溶解,消耗OH-
若推测1符合实际情况,则a点之前反应的离子方程式为Al3++3OH-═Al(OH)3↓,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异Al(OH)3比Mg(OH)2更难溶于水.
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.在0.1mol•L-1MgSO4、0.05mol•L-1Al2(SO4)3的混合溶液中滴加0.5mol•L-1NaOH溶液,他们借助氢离子传感器和相应的分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于碱式滴定管(填仪器名称)中滴加.
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是生成白色沉淀并逐渐增多.
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,同学们做出如下推测,请补充推测2和推测3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2:生成Al(OH)3沉淀消耗OH-
推测3:Al(OH)3沉淀溶解,消耗OH-
若推测1符合实际情况,则a点之前反应的离子方程式为Al3++3OH-═Al(OH)3↓,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异Al(OH)3比Mg(OH)2更难溶于水.
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
| 较大量存在的含金属元素的离子 | 检验方法 |
| Na+ | 用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+ |
| [Al(OH)4]- | 取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解 |
| 空 | 空 |
5.已知反应:KBrO3+AsH3+H2SO4--H3AsO4+K2SO4+H2O+Br2(未配平).下列叙述不正确的是( )
| A. | 反应中KBrO3得电子作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量比为5:8 | |
| C. | 根据上述反应可推知,还原性:AsH3>Br2 | |
| D. | 0.2 mol KBrO3参加反应电子转移1 mol |
 .
.