题目内容
4.下列说法不正确的是( )| A. | 地球上99%溴蕴藏在大海中,故溴被称为“海洋元素” | |
| B. | 高压钠灯发出的黄光射程特别远,故常用于道路与广场的照明 | |
| C. | 碳酸氢钠可与盐酸反应,故可作治疗胃酸过多的药剂 | |
| D. | 利用光线在硅晶体内的全反射现象,可以制备光导纤维 |
分析 A.溴主要存在与海洋中;
B.钠的焰色反应为黄色;
C.碳酸氢钠可与盐酸反应;
D.光导纤维的材料为二氧化硅.
解答 解:A.溴主要存在与海洋中,为海洋元素,故A正确;
B.钠的焰色反应为黄色,射程特别远,可用于道路与广场的照明,故B正确;
C.碳酸氢钠可与盐酸反应,可用于治疗胃酸过多,故C正确;
D.光导纤维的材料为二氧化硅,而硅用于半导体材料,故D错误.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.下列说法正确的是( )
| A. | 氨因为有刺激性气味,因此不用来做制冷剂 | |
| B. | 浓硫酸稀释是往浓硫酸中慢慢倒入水,并用玻璃棒不断的搅拌 | |
| C. | 元素周期表中,族序数都等于该元素原子的最外层电子数 | |
| D. | 往水玻璃中通入CO2:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ 可证明碳酸的酸性强于硅酸的酸性 |
12.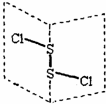 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )| A. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| B. | 反应中SO2是氧化产物,S是还原产物 | |
| C. | S2Cl2的分子构型与H2O2的分子构型相似 | |
| D. | 反应中,生成3molS,转移电子数目为3NA |
19.在带有活塞的密闭容器中发生反应:Fe2O3+3H2═2Fe+3H2O,采取下列措施不能改变反应速率的是( )
| A. | 将Fe2O3粉碎 | B. | 保持容器体积不变,增加H2输入量 | ||
| C. | 充入N2,保持容器内压强不变 | D. | 充入N2,保持容器内体积不变 |
9.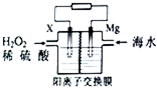 交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
 交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )
交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )| A. | X可为铁、铜、石墨等电极,发生氧化反应 | |
| B. | 每转移2 mol电子,2molH+由交换膜左侧向右侧迁移 | |
| C. | 该电池能将化学能全部转化成电能 | |
| D. | 正极的电极反应式为比O2+2e-+2H+═2H2O |
16.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2 L水中含有分子的数目为0.5NA | |
| B. | 100 mL 0.1 mol•L-1 Na2SO4溶液中,粒子总数是0.03NA | |
| C. | 标准状况下,33.6 LHF中含有氟原子的数目为1.5NA | |
| D. | 常温常压下,7.0 gC2H4与C3H6的混合物中含有氢原子的数目为NA |
13.提纯含有少量硝酸钡杂质的硝酸钾溶液,设计实验方案为:溶液$\stackrel{过量X}{→}$ $\stackrel{过滤}{→}$ $\stackrel{除去沉淀}{→}$ $\stackrel{适量硝酸}{→}$KNO3溶液
则X 试剂为( )
则X 试剂为( )
| A. | Na2CO3 | B. | K2CO3 | C. | Na2SO4 | D. | K2SO4 |
10.下列有关SO2性质的探究实验报告记录的实验现象正确的是( )
| 实验 | 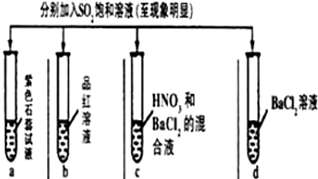 | ||||
| 记录 | A | 无色 | 无色 | 无色溶液 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |