题目内容
15.下列说法正确的是( )| A. | 氨因为有刺激性气味,因此不用来做制冷剂 | |
| B. | 浓硫酸稀释是往浓硫酸中慢慢倒入水,并用玻璃棒不断的搅拌 | |
| C. | 元素周期表中,族序数都等于该元素原子的最外层电子数 | |
| D. | 往水玻璃中通入CO2:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ 可证明碳酸的酸性强于硅酸的酸性 |
分析 A.液氨挥发吸热;
B.稀释时将密度大的液体注入密度小的液体中;
C.主族元素的族序数等于该元素原子的最外层电子数;
D.Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓为强酸制取弱酸的反应.
解答 解:A.液氨挥发吸热,则液氨可作制冷剂,与刺激性气味无关,故A错误;
B.稀释时将密度大的液体注入密度小的液体中,则将浓硫酸注入水中,并用玻璃棒不断的搅拌,故B错误;
C.主族元素的族序数等于该元素原子的最外层电子数,而副族元素、0族元素无此规律,故C错误;
D.Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓为强酸制取弱酸的反应,可知碳酸的酸性强于硅酸的酸性,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、元素周期表、实验操作及酸性比较方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
6.${\;}_{6}^{14}$C常用于考古学年代确定.下列关于${\;}_{6}^{14}$C的说法中正确的是( )
| A. | 中子数是6 | B. | 质量数是14 | C. | 电子数是14 | D. | 中子数是14 |
10.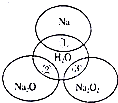 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 反应③最多能产生0.05molO2 | |
| B. | 反应①的离子方程式为Na+2H2O=Na++2OH-+H2↑ | |
| C. | ①、②、③都属于氧化还原反应 | |
| D. | ①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③ |
20.水是生命之源,也是重要的溶剂.下列有关水的说法正确的是( )
| A. | 水电解生成氢气和氧气,说明水中含有氢分子和氧分子 | |
| B. | 用肥皂水不可以区分硬水和软水 | |
| C. | 将黄河水经沉降、过滤、吸附,灭菌等净化操作后,可供人们生活用水 | |
| D. | 水体有一定的自净功能,部分工业污水可直接排放 |
7.常温下,将充满等体积混合气体的试管倒立在水槽中,试管内气体体积不会明显减少的一组是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ |
| NO、O2 | C2Hx、H2 | NO2、O2 | Cl2、SO2 | NH3、O2 | CO、O2 |
| A. | ②⑥ | B. | ②④ | C. | ③⑤ | D. | ①③ |
4.下列说法不正确的是( )
| A. | 地球上99%溴蕴藏在大海中,故溴被称为“海洋元素” | |
| B. | 高压钠灯发出的黄光射程特别远,故常用于道路与广场的照明 | |
| C. | 碳酸氢钠可与盐酸反应,故可作治疗胃酸过多的药剂 | |
| D. | 利用光线在硅晶体内的全反射现象,可以制备光导纤维 |
1.关于工业制硫酸的说法不正确的是( )
| A. | 燃烧硫生成SO3 | B. | SO3与水反应生成H2SO4 | ||
| C. | SO2氧化成SO3需要使用催化剂 | D. | 主要设备是沸腾炉、接触室、吸收塔 |
 如图所示两圆圈相交的部分表示圆圈内物质间相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
如图所示两圆圈相交的部分表示圆圈内物质间相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )