题目内容
12.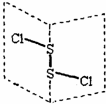 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.下列说法中错误的是( )| A. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| B. | 反应中SO2是氧化产物,S是还原产物 | |
| C. | S2Cl2的分子构型与H2O2的分子构型相似 | |
| D. | 反应中,生成3molS,转移电子数目为3NA |
分析 A.同种元素原子之间形成非极性键,不同元素的原子之间形成的化学键多为极性键,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称;
B.根据化合价降低为氧化剂生成还原产物,化合价升高为还原剂生成氧化产物判断;
C.S2Cl2分子中S-S为非极性键,S-Cl键为极性键,H2O2分子中O-O为非极性键,H-O键为极性键;
D.根据元素的化合价升降来确定电子转移情况.
解答 解:A.S2Cl2分子中S-S为非极性键,S-Cl键为极性键,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子,故A错误;
B.S2Cl2硫化合价由+1降低为0价硫,所以S为还原产物,S2Cl2硫化合价由+1升高为+4价SO2,所以SO2为氧化产物,故B正确;
C.S2Cl2分子中S-S为非极性键,S-Cl键为极性键,H2O2分子中O-O为非极性键,H-O键为极性键,S2Cl2的分子构型与H2O2的分子构型相似,故C正确;
D.在反应中,S元素发生自身氧化还原反应,S2Cl2硫化合价由+1升高为+4价SO2,所以生成1molSO2,转移电子为3mol,即转移电子数目为3NA,故D正确;
故选A.
点评 本题以S2Cl2的结构为载体,考查分子结构、化学键、电子式、氧化还原反应等,难度不大,是对基础知识的综合运用与学生能力的考查,注意基础知识的全面掌握.

练习册系列答案
相关题目
20.水是生命之源,也是重要的溶剂.下列有关水的说法正确的是( )
| A. | 水电解生成氢气和氧气,说明水中含有氢分子和氧分子 | |
| B. | 用肥皂水不可以区分硬水和软水 | |
| C. | 将黄河水经沉降、过滤、吸附,灭菌等净化操作后,可供人们生活用水 | |
| D. | 水体有一定的自净功能,部分工业污水可直接排放 |
7.常温下,将充满等体积混合气体的试管倒立在水槽中,试管内气体体积不会明显减少的一组是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ |
| NO、O2 | C2Hx、H2 | NO2、O2 | Cl2、SO2 | NH3、O2 | CO、O2 |
| A. | ②⑥ | B. | ②④ | C. | ③⑤ | D. | ①③ |
17.将a mol/L Al2(SO4)3和钾离子浓度为2b mol/L的 K2SO4混合溶液500mL加水稀释到2L,则稀释后的溶液中SO42-的浓度为( )mol/L.
| A. | $\frac{a+b}{4}$ | B. | 4(3a+b) | C. | 4(a+b) | D. | $\frac{3a+b}{4}$ |
4.下列说法不正确的是( )
| A. | 地球上99%溴蕴藏在大海中,故溴被称为“海洋元素” | |
| B. | 高压钠灯发出的黄光射程特别远,故常用于道路与广场的照明 | |
| C. | 碳酸氢钠可与盐酸反应,故可作治疗胃酸过多的药剂 | |
| D. | 利用光线在硅晶体内的全反射现象,可以制备光导纤维 |
1. 如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )
如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )
 如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )
如图,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下,若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则关于原来H2、O2的体积比下列正确的是( )| A. | 4:17 | B. | 3:7 | C. | 8:13 | D. | 7:4 |
18.某浓度的硝酸与过量铁粉反应,生成标况下一氧化二氮气体4.48L.若改用铝反应,假设只生成一氧化氮气体,则最多可溶解铝的量( )
| A. | 13.5g | B. | 9g | C. | 27g | D. | 0.33mol |
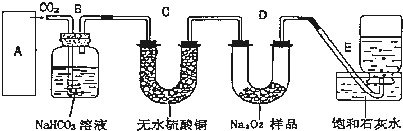
 如图所示两圆圈相交的部分表示圆圈内物质间相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
如图所示两圆圈相交的部分表示圆圈内物质间相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )