题目内容
14.已知图中H是无色液体,号称生命之源,B是空气中含量最多的物质,E是红棕色气体.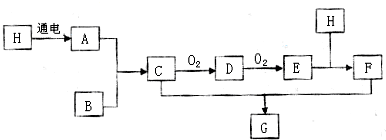
(1)C、F的化学式分别是NH3、HNO3
(2)C→D 是工业的重要反应,写出其反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6 H2O
(3)D和E都是大气污染物,两种物质可以相互转化,写出E→D的化学方程式3NO2+H2O=2HNO3+NO
若是氧化还原反应,指出氧化剂;若不是氧化还原反应,说明原因是氧化还原反应,氧化剂是NO2
(4)用两根玻璃棒分别蘸取C和F浓溶液相互靠近,现象为产生白烟生成的G属于盐(选“酸”“碱”“盐”“氧化物”)
分析 H是无色液体,号称生命之源,推断H为H2O,B是空气中含量最多的物质,则B为N2,E是红棕色气体,经过两步氧化得到,判断E为NO2,结合转化关系可推知,A为H2,C为NH3,D为NO,F为HNO3,G为NH4NO3.
解答 解:H是无色液体,号称生命之源,推断H为H2O,B是空气中含量最多的物质,则B为N2,E是红棕色气体,经过两步氧化得到,判断E为NO2,结合转化关系可推知,A为H2,C为NH3,D为NO,F为HNO3,G为NH4NO3.
(1)C的化学式为NH3,F的化学式为:HNO3,
故答案为:NH3;HNO3;
(2)C→D 是工业的重要反应,其反应的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6 H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6 H2O;
(3)D和E都是大气污染物,两种物质相互转化,E→D的化学方程式为:3NO2+H2O=2HNO3+NO,N元素化合价发生变化,是氧化还原反应,氧化剂是NO2,
故答案为:3NO2+H2O=2HNO3+NO;是氧化还原反应,氧化剂是NO2;
(4)用两根玻璃棒分别蘸取C和F浓溶液相互靠近,挥发出的氨气与硝酸反应:HNO3+NH3=NH4NO3,产生白烟,生成盐,
故答案为:产生白烟;盐.
点评 本题考查无机物推断,物质的颜色、含量、状态等是推断突破口,熟练掌握元素化合物知识,掌握中学常见连续氧化反应.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
4.有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)A原子的核外电子排布式1s22s22p63s1.
(2)B元素在周期表中的位置第3周期第ⅢA族;简单离子半径:B离子小于C离子(填“大于”或“小于”).
(3)D原子的外围电子排布式为3s23p5.
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应水化物反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,与C的最高价氧化物对应水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式1s22s22p63s1.
(2)B元素在周期表中的位置第3周期第ⅢA族;简单离子半径:B离子小于C离子(填“大于”或“小于”).
(3)D原子的外围电子排布式为3s23p5.
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应水化物反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,与C的最高价氧化物对应水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
9.日常生活离不开洗涤.下列使用的洗涤剂不正确的是( )
| A. | 用纯碱溶液清洗餐具上的油污 | B. | 用漂白液洗涤衣服上的字迹 | ||
| C. | 用稀硫酸清洗水壶里的水垢 | D. | 用汽油清洗皮肤上的油漆 |
6.${\;}_{6}^{14}$C常用于考古学年代确定.下列关于${\;}_{6}^{14}$C的说法中正确的是( )
| A. | 中子数是6 | B. | 质量数是14 | C. | 电子数是14 | D. | 中子数是14 |
4.下列说法不正确的是( )
| A. | 地球上99%溴蕴藏在大海中,故溴被称为“海洋元素” | |
| B. | 高压钠灯发出的黄光射程特别远,故常用于道路与广场的照明 | |
| C. | 碳酸氢钠可与盐酸反应,故可作治疗胃酸过多的药剂 | |
| D. | 利用光线在硅晶体内的全反射现象,可以制备光导纤维 |
 如图所示两圆圈相交的部分表示圆圈内物质间相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
如图所示两圆圈相交的部分表示圆圈内物质间相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )