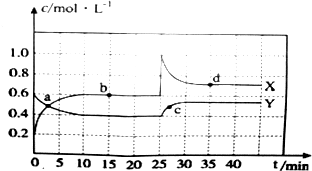
题目内容
6.NaHA是二元酸H2A的酸式盐,下列说法不正确的是( )| A. | 若NaHA溶液呈酸性,则H2A一定是强酸 | |
| B. | 若NaHA溶液呈碱性,则H2A一定是弱酸 | |
| C. | NaHA溶液中Na+和HA-的个数之比一定大于1:1 | |
| D. | NaHA晶体中的阴阳离子个数比一定是1:1 |
分析 A、有弱离子的盐才能水解;
B、弱酸的酸式酸根离子,能发生水解也能发生电离;
C、HA-的水解和电离会使得离子浓度减小;
D、NaHA晶体中的离子不存在电离和水解.
解答 解:A、有弱离子的盐才能水解,若NaHA的水溶液呈酸性,若只电离,则二元酸为强酸,若NaHA的水溶液中HA-的电离大于其水解,则二元酸H2A也可能为弱酸,故A错误;
B、HA-是酸式酸根离子,能发生水解也能发生电离,当水解程度大于电离程度时,溶液显碱性,说明H2A一定是弱酸,故B正确;
C、HA-的水解和电离会使得离子浓度减小,NaHA溶液中Na+和HA-的个数之比大于1:1,故C正确;
D、NaHA晶体中的离子不存在电离和水解,阴阳离子个数比都是1:1,故D正确.
故选A.
点评 本题考查了弱电解质的电离和盐的水解,题目难度不大,侧重于基础知识的考查,注意把握酸式盐的电离和水解程度的相对大小对溶液酸碱性的影响.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列叙述正确的是( )
| A. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 | |
| B. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 |
17.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,
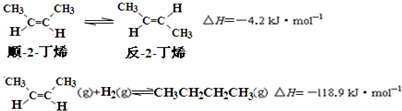
下列说法正确的是( )

下列说法正确的是( )
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: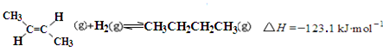 |
1.下列说法正确的是( )
| A. | 石油的分馏和煤的干馏都是物理变化 | |
| B. | 甲烷、苯、乙醇都可以发生取代反应 | |
| C. | 淀粉和纤维素互为同分异构体 | |
| D. | 糖类都能发生水解反应 |
11.下列离子方程式正确的是( )
| A. | 金属钠与水反应:Na+H2O═Na++H2 | |
| B. | 氯化铵溶液显酸性的原因:NH4++H2O═NH3•H2O+H+ | |
| C. | AICl3溶液中加入足量氨水:Al3++4NH3•H2O═AlO2-+4NH4+2H2O | |
| D. | 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S═2Fe2++S+2H+ |
18.下列物质一定属于同系物的是( )
① ②
② ③
③
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6
⑦ ⑧
⑧
①
 ②
② ③
③
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6
⑦
 ⑧
⑧
| A. | ①和② | B. | ④和⑥ | C. | ⑤和⑥ | D. | ④和⑧ |