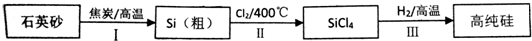题目内容
11.下列离子方程式正确的是( )| A. | 金属钠与水反应:Na+H2O═Na++H2 | |
| B. | 氯化铵溶液显酸性的原因:NH4++H2O═NH3•H2O+H+ | |
| C. | AICl3溶液中加入足量氨水:Al3++4NH3•H2O═AlO2-+4NH4+2H2O | |
| D. | 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S═2Fe2++S+2H+ |
分析 A.电荷不守恒,原子个数不守恒;
B.盐类水解为可逆反应,用可逆号;
C.不符合反应客观事实;
D.二者发生氧化还原反应,三价铁离子氧化硫离子生成硫单质,本身被还原为二价铁离子.
解答 解:A.金属钠与水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.氯化铵溶液显酸性的原因,离子方程式:NH4++H2O?NH3•H2O+H+,故B错误;
C.AICl3溶液中加入足量氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.氯化铁溶液中滴加少量的硫化氢溶液,离子方程式:2Fe3++H2S═2Fe2++S+2H+,故D正确;
故选:D.
点评 本题考查学生离子方程式书写知识,明确物质的性质是解题关键,注意离子反应遵循客观事实,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.NaHA是二元酸H2A的酸式盐,下列说法不正确的是( )
| A. | 若NaHA溶液呈酸性,则H2A一定是强酸 | |
| B. | 若NaHA溶液呈碱性,则H2A一定是弱酸 | |
| C. | NaHA溶液中Na+和HA-的个数之比一定大于1:1 | |
| D. | NaHA晶体中的阴阳离子个数比一定是1:1 |
11.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 25℃,等物质的量浓度的CH3COO-、ClO-、CO32-和SO32-,结合质子能力最强的是ClO- | |
| B. | 少量的SO2通入Na2CO3溶液中反应的离子方程式为:SO2+H2O+2CO32-═2HCO3-+SO32- | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═CO32-+2HClO |
12.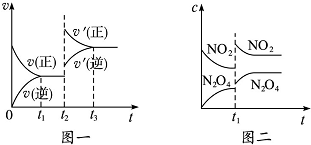 已知图一表示的是可逆反应C(s)+H2O(g)?CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
已知图一表示的是可逆反应C(s)+H2O(g)?CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
 已知图一表示的是可逆反应C(s)+H2O(g)?CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
已知图一表示的是可逆反应C(s)+H2O(g)?CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )| A. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| B. | 图一t2时改变的条件是增大压强,则反应的△H增大 | |
| C. | 图二t1时改变的条件可能是升高了温度 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
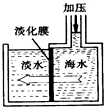 我国有较长的海岸线,浩渺的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.
我国有较长的海岸线,浩渺的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.