题目内容
16.下列叙述正确的是( )| A. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 | |
| B. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 |
分析 A.根据N=nNA计算;
B.物质的状态不一定相同;
C.气体的体积与温度和压强有关;
D.根据m=ρV计算.
解答 解:A.任何条件下,等物质的量的甲烷和一氧化碳,由N=nNA可知,分子数相同,故A正确;
B.同温同压下,相同体积的气体,其物质的量一定相等,若不是气体,物质的量不一定相等,故B错误;
C.1L一氧化碳气体与1L氧气所处的状态相同,1L一氧化碳气体一定比1L氧气的质量小,但二者所处的状态不一定相同,因此1L一氧化碳气体与1L氧气的质量关系无法确定,故C错误;
D.由m=ρV可知,质量与密度和体积有关,若体积相等,密度不一定相同,所以质量不一定相等,故D错误.
故选A.
点评 本题阿伏伽德罗定律及推论,侧重于学生的分析能力的考查,难度不大,注意把握阿伏伽德罗定律只适合气体,比较气体的质量、物质的量大小时,要注意气体存在的条件,为易错点.

练习册系列答案
相关题目
6.由于Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3,如图图所示中能较长时间看到Fe(OH)2白色沉淀的是( )
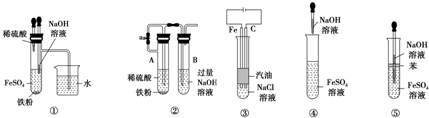

| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②③④⑤ | D. | ③⑤ |
4.为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法均正确的是( )
| 物质 | 除杂试剂 | 分离方法 | |
| A | 硫酸亚铁溶液(硫酸铜) | 铁粉 | 结晶 |
| B | BaSO4(BaCO3) | 盐酸 | 过滤 |
| C | NaCl溶液(I2) | 乙醇 | 分液 |
| D | 铁粉(铜粉) | 硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
8.25℃时,水中存在电离平衡:2H2O?H3O++OH-△H>0.下列叙述正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量NH4Cl固体,抑制水的电离 | |
| C. | 向水中加入少量NaOH固体,促进水的电离 | |
| D. | 向水中加入少量NaHSO4固体,抑制水的电离,c(H+)增大,Kw不变 |
5.将30mL0.5mol/LH2SO4溶液加水稀释到500mL,稀释后溶液中H+的物质的量浓度为( )
| A. | 0.03mol/L | B. | 0.04mol/L | C. | 0.05mol/L | D. | 0.06mol/L |
6.NaHA是二元酸H2A的酸式盐,下列说法不正确的是( )
| A. | 若NaHA溶液呈酸性,则H2A一定是强酸 | |
| B. | 若NaHA溶液呈碱性,则H2A一定是弱酸 | |
| C. | NaHA溶液中Na+和HA-的个数之比一定大于1:1 | |
| D. | NaHA晶体中的阴阳离子个数比一定是1:1 |