题目内容
7.将含有一摩尔Na2CO3的溶液逐滴入含有1.25molHCl的稀盐酸中,混合充分反应,产生气体V1,若将上述稀盐酸全部逐滴滴入Na2CO3溶液中,混合充分反应,产生气体V2.在相同条件下V1与V2之比为( )| A. | 1:1 | B. | 2:5 | C. | 5:2 | D. | 2:3 |
分析 把Na2CO3溶液逐滴加到盐酸中,发生反应Na2CO3+2HCl═2NaCl+H2O+CO2↑,
将盐酸滴到Na2CO3溶液中,发生反应Na2CO3+HCl═NaHCO3+NaCl、NaHCO3+HCl═NaCl+CO2↑+H2O,
根据滴加顺序不同,反应也不同,现象不同,根据方程式进行计算.
解答 解:把Na2CO3溶液逐滴加到盐酸中,则发生反应即Na2CO3+2HCl═2NaCl+H2O+CO2↑,开始就有气体放出.
Na2CO3 +2HCl═2NaCl+H2O+CO2↑
1 2 1
1mol 1.25mol V1
V1=1.25mol×$\frac{1}{2}$=0.625mol;
若将盐酸滴到Na2CO3溶液中,开始时Na2CO3过量,只发生反应①Na2CO3+HCl=NaHCO3+NaCl,无气体,只有在Na2CO3全部转化成NaHCO3后再滴加盐酸才有气体放出.
Na2CO3 +HCl═NaHCO3 +NaCl
1 1 1
1mol 1.25mol 1mol
NaHCO3 +HCl═NaCl+CO2↑+H2O
1mol 0.25mol V2
V2 =0.25mol×$\frac{1}{1}$=0.25mol,
$\frac{{V}_{1}}{{V}_{2}}$=$\frac{0.625mol}{0.25mol}$=5:2,
故选C.
点评 本题主要考查了Na2CO3与盐酸的反应,难度中等,试剂的滴加顺序不同,反应历程不同,现象也不同.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
6.NaHA是二元酸H2A的酸式盐,下列说法不正确的是( )
| A. | 若NaHA溶液呈酸性,则H2A一定是强酸 | |
| B. | 若NaHA溶液呈碱性,则H2A一定是弱酸 | |
| C. | NaHA溶液中Na+和HA-的个数之比一定大于1:1 | |
| D. | NaHA晶体中的阴阳离子个数比一定是1:1 |
18.四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,Y、W质子数之和是Z质子数的2倍.则下列说法中正确的是( )
| A. | 原子半径比较:X<Y<Z<W | |
| B. | X2H4与H2W都能使溴水褪色 | |
| C. | X的氢化物的沸点一定低于Y的氢化物的沸点 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
15.过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后,最后排出气体,残留的物质应是( )
| A. | Na2O和Na2O2 | B. | Na2O2和Na2CO3 | C. | Na2CO3 | D. | Na2O |
12.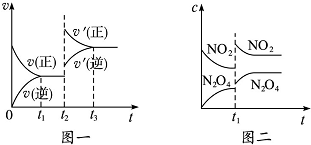 已知图一表示的是可逆反应C(s)+H2O(g)?CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
已知图一表示的是可逆反应C(s)+H2O(g)?CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
 已知图一表示的是可逆反应C(s)+H2O(g)?CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
已知图一表示的是可逆反应C(s)+H2O(g)?CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )| A. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| B. | 图一t2时改变的条件是增大压强,则反应的△H增大 | |
| C. | 图二t1时改变的条件可能是升高了温度 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
19.近年来,光化学烟雾污染问题已引起人们的注意,下列哪种气体是造成光化学烟雾的主要因素( )
| A. | NO2 | B. | SO2 | C. | CO2 | D. | Cl2 |
16.据粗略统计,我国没有处理排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染.为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚,其中甲醇产量在2012年末已达到500~600万吨.请回答下列问题:
(1)已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)?CH3OH(g)△H1.如表所列为常见化学键的键能数据:
则该反应的△H1=-128.8 kJ•mol-1.
(2)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.已知利用焦炉气合成二甲醚的三步反应如下:
ⅰ.2H2(g)+CO(g)?CH3OH(g)△H1
ⅱ.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
ⅲ.CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.3kJ•mol-1
①总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-322.4kJ•mol-1.
②下列描述中能说明上述总反应已达平衡的是C.
A.c(H2)、c(CO)、c(CH3OCH3)、c(CO2)均为0.1mol•L-1
B.2v(H2)正=v(CH3OCH3)逆
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成n mol H2
③一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ace.
a.增大压强 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)①甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图甲,该燃料电池的电池反应式为2CH3OH (g)+3O2(g)═2CO2(g)+4H2O(l),则正极的电极反应式为4H++4e-+O2=2H2O.
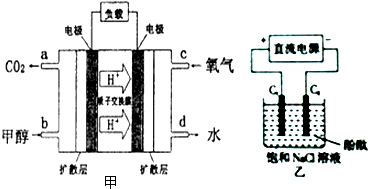
②用上述电池做电源,用图乙装置电解饱和食盐水(C1、C2均为石墨电极),该反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2OH-+Cl2↑+H2↑,电解初始在电极C2(填“C1”或“C2”)的周围先出现红色.
③当有8g甲醇完全反应,在C2上可收集到标准状况下气体的体积为16.8L.
(1)已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)?CH3OH(g)△H1.如表所列为常见化学键的键能数据:
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
(2)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.已知利用焦炉气合成二甲醚的三步反应如下:
ⅰ.2H2(g)+CO(g)?CH3OH(g)△H1
ⅱ.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
ⅲ.CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.3kJ•mol-1
①总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-322.4kJ•mol-1.
②下列描述中能说明上述总反应已达平衡的是C.
A.c(H2)、c(CO)、c(CH3OCH3)、c(CO2)均为0.1mol•L-1
B.2v(H2)正=v(CH3OCH3)逆
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成n mol H2
③一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ace.
a.增大压强 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)①甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图甲,该燃料电池的电池反应式为2CH3OH (g)+3O2(g)═2CO2(g)+4H2O(l),则正极的电极反应式为4H++4e-+O2=2H2O.

②用上述电池做电源,用图乙装置电解饱和食盐水(C1、C2均为石墨电极),该反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2OH-+Cl2↑+H2↑,电解初始在电极C2(填“C1”或“C2”)的周围先出现红色.
③当有8g甲醇完全反应,在C2上可收集到标准状况下气体的体积为16.8L.
17.向三份均为100mL0.5mol•L-1NaHCO3溶液中,分别加入少量冰醋酸、Ca(OH)2固体、NaAlO2固体(忽略溶液体积变化),则三份溶液中c(CO32-)的变化依次为( )
| A. | 减小、减小、增大 | B. | 减小、增大、增大 | C. | 增大、减小、减小 | D. | 减小、增大、减小 |
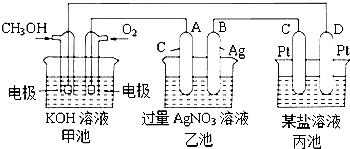 图是一个化学过程的示意图.
图是一个化学过程的示意图.