题目内容
18.我国科学家发现了一种新核素${\;}_{80}^{208}$Hg,它的中子数为( )| A. | 288 | B. | 208 | C. | 80 | D. | 128 |
分析 新的核素${\;}_{80}^{208}$Hg中质子数是80,质量数是208,质量数=质子数+中子数,从而计算中子数即可.
解答 解:新的核素${\;}_{80}^{208}$Hg中质子数是80,质量数是208,中子数=质量数-质子数=208-80=128,
故选B.
点评 本题考查了质量数、质子数和中子数之间的关系,难度不大,明确原子中数字的意义.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.对于第三周期从左到右的主族元素,下列说法中不正确的是( )
| A. | 原子半径逐渐减小 | B. | 电子层数逐渐增多 | ||
| C. | 最高正化合价逐渐增大 | D. | 元素的非金属性逐渐减弱 |
9.下列叙述不正确的是( )
| A. | H2S与SO2、NO与O2、NH3与HCl在常温下均不能大量共存 | |
| B. | (NH4)2SO3、Ca(HCO3)2、NaAlO2均既能和稀硫酸又能和氢氧化钠溶液反应 | |
| C. | Fe(OH)3、FeCl2、FeCl3均可通过化合反应得到 | |
| D. | 制备Fe(OH)2时加苯液封,同时将滴管插入苯层液面以下,其目的是防止Fe(OH)2被空气氧化 |
13.下列有关说法正确的是( )
| A. | Hg(l)+H2SO4(aq)=HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 | |
| B. | 在一密闭容器中发生2SO2(g)+O2(g)?2SO3(g)反应,平衡后增大压强,平衡会正向移动,$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$值增大 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 |
3.现有A、B、C三种金属,把A浸入C的盐溶液中,A的表面有C析出;把A、B用导线连接后同时浸入稀硫酸中,电子流动方向为:B→导线→A.A、B、C三种金属的活动性顺序为( )
| A. | B>A>C | B. | A>C>B | C. | A>B>C | D. | B>C>A |
10.如图是氢氧燃料电池结构示意图,下列关于该电池的说法中,正确的是( )
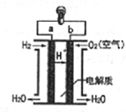

| A. | b极是负极 | B. | 正极发生氧化反应 | ||
| C. | a极的电极反应是H2-2e-=2H+ | D. | 该电池工作时,有淡蓝色火焰产生 |
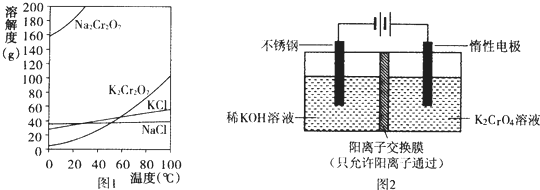
7.下列有关化学反应原理的分析错误的是( )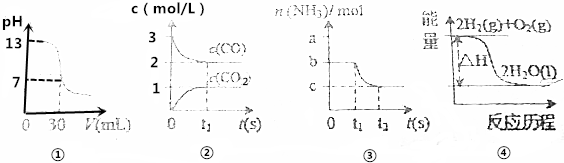
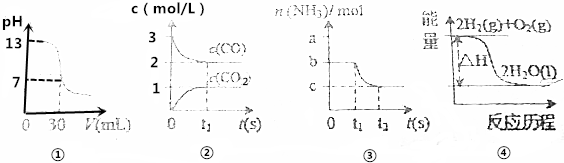
| A. | 图①表示25℃时,0.1000mol•L-1某一元酸滴定25.00mL 0.1000mol•L-1NaOH溶液,则根据图中数据可以计算出该温度下该一元酸的电离常数Ka | |
| B. | 图②表示某温度下的反应2CO(g)?C(s)+CO2(g)中的气体浓度随时间变化的曲线,则根据图中数据可计算该温度下的平衡常数K | |
| C. | 图③表示N2(g)+3H2(g)?2NH3(g)的平衡移动曲线,t1时刻改变的条件可能是降低压强 | |
| D. | 图④表示的反应热△H,可根据H2、O2、H2O的共价键的键能计算 |
8.用下列方法制取氢气,反应速率最大的是( )
| A. | 30℃,块状锌与2 mol•L一1硫酸溶液反应 | |
| B. | 30℃,粉末状铁与2 mol•L一1硫酸溶液反应 | |
| C. | 60℃,粉末状锌与2 mol•L一1硫酸溶液反应 | |
| D. | 60℃,粉末状镁与2mol•L一1硫酸溶液反应 |