题目内容
8.对于第三周期从左到右的主族元素,下列说法中不正确的是( )| A. | 原子半径逐渐减小 | B. | 电子层数逐渐增多 | ||
| C. | 最高正化合价逐渐增大 | D. | 元素的非金属性逐渐减弱 |
分析 A、当电子层数相同时,核电荷数越大,半径越小;
B、电子层数=周期序数;
C、最高正价=最外层电子数;
D、同一周期从左向右,非金属性逐渐增强.
解答 解:对于第三周期从左到右的主族元素,电子层数相同,核电荷数逐渐增大.
A、当电子层数相同时,核电荷数越大,半径越小,故于第三周期从左到右的主族元素,原子半径逐渐减小,故A正确;
B、电子层数=周期序数,由于都是第三周期的元素,故电子层数均为三层,故B错误;
C、最高正价=最外层电子数,由于第三周期的主族元素从左到右的最外层电子数由1个递增到7个,故最高正价从+1价递增到+7价,逐渐增大,故C错误;
D、同一周期从左向右,非金属性逐渐增强,故第三周期的主族元素从左到右,非金属性逐渐增强,故D错误.
故选A.
点评 本题考查了同周期元素的原子半径、电子层数、最高正价和非金属性的强弱比较,难度不,掌握元素周期律是解题关键.

练习册系列答案
相关题目
15.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,2.24LNO和2.24LO2混合气体分子数为0.15NA | |
| C. | 加热条件,1molFe投入足量的浓硫酸,生成NA个SO2分子 | |
| D. | 0.1molNa2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA |
16.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸反应 | B. | 灼热的木炭与CO2反应 | ||
| C. | 乙醇在氧气中燃烧 | D. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 |
3.下列物质在水中可以分层,且上层是水层的是 ( )
| A. | 苯 | B. | 乙醇 | C. | 溴苯 | D. | 四氯化碳 |
20.在已经处于化学平衡状态的体系中,如果下列量发生变化,化学平衡一定会移动的是( )
| A. | 反应物和生成物的浓度改变 | B. | 反应体系的压强改变 | ||
| C. | 正、逆反应的速率改变 | D. | 反应物的转化率改变 |
17.下列化学用语表达正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 甲烷分子的球棍模型: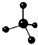 | ||
| C. | 乙醇的分子式:C2H5OH | D. | 氟离子的结构示意图: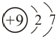 |
18.我国科学家发现了一种新核素${\;}_{80}^{208}$Hg,它的中子数为( )
| A. | 288 | B. | 208 | C. | 80 | D. | 128 |