题目内容
8.用下列方法制取氢气,反应速率最大的是( )| A. | 30℃,块状锌与2 mol•L一1硫酸溶液反应 | |
| B. | 30℃,粉末状铁与2 mol•L一1硫酸溶液反应 | |
| C. | 60℃,粉末状锌与2 mol•L一1硫酸溶液反应 | |
| D. | 60℃,粉末状镁与2mol•L一1硫酸溶液反应 |
分析 影响化学反应速率快慢的主要因素是物质本身的性质,不同金属与同浓度的酸反应,金属活泼反应速率越快,以此解答.
解答 解:金属活泼性镁强于锌,锌强于铁,所以反应速率最快的是镁,故选D.
点评 本题考查化学反应速率的影响因素,侧重于学生的分析能力的考查,为高考高频考点,注意把握影响反应速率的因素,注重相关知识的学习与积累,难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
18.我国科学家发现了一种新核素${\;}_{80}^{208}$Hg,它的中子数为( )
| A. | 288 | B. | 208 | C. | 80 | D. | 128 |
19.短期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )


| A. | X、Y、Z中Z的单质最稳定 | B. | Y的氢化物为H2Y | ||
| C. | H2Z能发生反应:Cl2+H2Z=Z+2HCl | D. | Y有含氧酸为HYO |
16.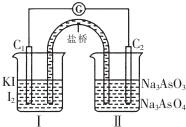 已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:
已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;(提示:按正反应发生)
②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反.(提示:按逆反应发生)
下列有关说法中不正确的是( )
 已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:
已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;(提示:按正反应发生)
②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反.(提示:按逆反应发生)
下列有关说法中不正确的是( )
| A. | ①操作过程中C1棒上发生的反应为2I--2e-═I2 | |
| B. | ②操作过程中盐桥中的阳离子移向(Ⅰ)烧杯 | |
| C. | 若将微安表换成惰性电极电解饱和食盐水的装置,在①操作过程中与C1棒连接的电极上有Cl2产生 | |
| D. | 若将微安表换成电解精炼铜装置,在②操作过程中与C2棒连接的为纯铜电极 |
3.对于A2+3B2═2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=0.9mol/(L•s) | B. | v(A2)=0.5mol/(L•s) | ||
| C. | v(C)=0.62mol/(L•s) | D. | v(B2)=4.2mol/(L•min) |
13.对于可逆反应C(s)+H2O(g)?CO+H2一Q.下列说法正确的是( )
| A. | 由于反应前后分子数相等,所以加压后,平衡不移动 | |
| B. | 平衡时c(H2O)(g)、c(CO)、c(H2)保持不变 | |
| C. | 达到平衡时,c(H2O)(g)═c(CO)=c(H2) | |
| D. | 升高温度,V正增大,V逆减小,所以平衡向右移动 |
20.钯(Pd)元素的原子序数为46,下列叙述错误的是( )
| A. | ${\;}_{46}^{102}$Pd和${\;}_{46}^{103}$Pd互为同位素 | |
| B. | 钯是第五周期元素 | |
| C. | Pd2+核外有48个电子 | |
| D. | ${\;}_{62}^{108}$Pd的原子核内有62个中子 |
18.能源开发、环保、资源利用等与化学密切相关.下列说法错误的是( )
| A. | 化石燃料的开采和使用可以解决能源危急 | |
| B. | 国家积极推广使用节能环保材料利于环境保护 | |
| C. | 探索太阳能、氢能、地热能、海洋能和生物能的生物能的使用对解决能源危急有重要意义 | |
| D. | 化学反应过程中同时存在着物质和能量的变化 |