题目内容
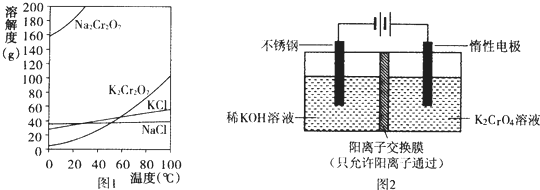
6.重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等.其水溶液中存在平衡:Cr2O72-+H2O?2CrO42-+2H+(1)已知有关物质溶解度如图1.用复分解法制备K2Cr2O7的操作过程是:向Na2Cr2O7溶液中加入KCl(填化学式),搅拌溶解,调节溶液pH约为5,加热溶液至表面有少量晶体析出时,冷却结晶,抽滤得到粗产品,再用重结晶法提纯粗产品.
(2)以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图2.
①不锈钢作阴极,写出该电极的电极反应式2H2O+2e-=2OH-+H2↑.
②分析阳极区能得到重铬酸钾溶液的原因阳极OH-放电,溶液中H+浓度增大,使Cr2O72-+H2O?2CrO42-+2H+向生成Cr2O72-方向移动,部分K+通过阳离子交换膜移动到阴极区,使阳极区主要成分是K2Cr2O7.
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为2:(1-0.5x).
(3)铬对环境能造成污染.某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH约为8,使铬元素沉降,分离出污泥后检测废水中Cr3+浓度,低于0.5mg•L-1则达到排放标准.
①Na2S2O5参加反应的离子方程式为3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O.
②经上述工艺处理后的废水,理论上Cr3+浓度约为3×10-8mg•L-1.
(已知室温下Ksp[Cr(OH)3]≈6×10-31)
分析 (1)Na2Cr2O7水溶液中加KCl,加热浓缩、冷却结晶,可得到K2Cr2O7;
(2)①与电源的负极相连作阴极;阴极上氢离子得电子生成氢气;
②阳极上溶液中阴离子放电,氢氧根离子失电子发生氧化反应,氢离子浓度增大使Cr2O72-+H2O?2CrO42-+2H+向生成Cr2O72-方向移动;
③设K2CrO4为1mol,则K+为2mol,铬酸钾的转化率达到x,则生成为K2Cr2O70.5xmol,K2CrO4剩余为1-xmol,据此计算;
(3)①焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,同时焦亚硫酸钠被氧化为硫酸钠,根据电子守恒和原子守恒书写方程式;
②pH约为8,则c(OH-)=10-6mol/L,根据Ksp[Cr(OH)3]≈6×10-31计算c(Cr3+),再求出质量浓度.
解答 解:(1)由图可知Na2Cr2O7的溶解度较大,K2Cr2O7的溶解度较小,Na2Cr2O7水溶液中加KCl,加热浓缩、冷却结晶,可得到K2Cr2O7;
故答案为:KCl;冷却结晶;
(2)①与电源的负极相连作阴极;阴极上氢离子得电子生成氢气,则阴极的电极方程式为:2H2O+2e-=2OH-+H2↑;
故答案为:阴;2H2O+2e-=2OH-+H2↑;
②阳极上溶液中阴离子放电,氢氧根离子失电子发生氧化反应,氢离子浓度增大使Cr2O72-+H2O?2CrO42-+2H+向生成Cr2O72-方向移动;
故答案为:阳极OH-放电,溶液中H+浓度增大,使Cr2O72-+H2O?2CrO42-+2H+向生成Cr2O72-方向移动,部分K+通过阳离子交换膜移动到阴极区,使阳极区主要成分是K2Cr2O7;
③设K2CrO4为1mol,则K+为2mol,铬酸钾的转化率达到x,则生成为K2Cr2O70.5xmol,K2CrO4剩余为1-xmol,
则阳极液中K与Cr的物质的量之比为2:(1-x+0.5x)=2:(1-0.5x);
故答案为:2:(1-0.5x);
(3)①焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,同时焦亚硫酸钠被氧化为硫酸钠,其反应的离子方程式为:3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O;
故答案为:3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O;
②pH约为8,则c(OH-)=10-6mol/L,已知Ksp[Cr(OH)3]≈6×10-31,c(Cr3+)=$\frac{6×1{0}^{-31}}{(1{0}^{-6})^{3}}$=6×10-13mol/L,则1L溶液中Cr元素的质量为6×10-13mol×52g/mol=3.126×10-11g≈3×10-8mg,则理论上Cr3+浓度约为3×10-8mg/L;
故答案为:3×10-8.
点评 本题考查物质的制备的综合应用,把握物质的制备方法、电解原理、溶度积常数的计算为解答的关键,注意信息的应用及相关计算,侧重分析与实验、计算能力的综合考查,题目难度中等.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案| A. | 锌粒与稀硫酸反应 | B. | 灼热的木炭与CO2反应 | ||
| C. | 乙醇在氧气中燃烧 | D. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 甲烷分子的球棍模型: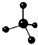 | ||
| C. | 乙醇的分子式:C2H5OH | D. | 氟离子的结构示意图: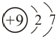 |
| A. | O2[PtF6]中只含离子键 | B. | O2[PtF6]中氧元素化合价为+1 | ||
| C. | 反应中O2是氧化剂,PtF6是还原剂 | D. | 每生成1molO2PtF6转移1mol电子 |
| A. | 4种 | B. | 6种 | C. | 10种 | D. | 14种 |
| A. | 288 | B. | 208 | C. | 80 | D. | 128 |
| A. | 第1A族均为碱金属元素 | |
| B. | 最外层有两个电子的原子一定在第ⅡA族 | |
| C. | 元素的最高化合价等于其原子的最外层电子数 | |
| D. | 第ⅦA族元素的阴离子还原性越强,其气态氢化物的稳定性越弱 |
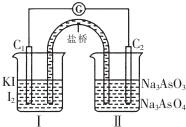 已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:
已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;(提示:按正反应发生)
②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反.(提示:按逆反应发生)
下列有关说法中不正确的是( )
| A. | ①操作过程中C1棒上发生的反应为2I--2e-═I2 | |
| B. | ②操作过程中盐桥中的阳离子移向(Ⅰ)烧杯 | |
| C. | 若将微安表换成惰性电极电解饱和食盐水的装置,在①操作过程中与C1棒连接的电极上有Cl2产生 | |
| D. | 若将微安表换成电解精炼铜装置,在②操作过程中与C2棒连接的为纯铜电极 |
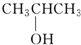 ⑨${\;}_{6}^{13}$C (填序号)
⑨${\;}_{6}^{13}$C (填序号)