题目内容
9.下列叙述不正确的是( )| A. | H2S与SO2、NO与O2、NH3与HCl在常温下均不能大量共存 | |
| B. | (NH4)2SO3、Ca(HCO3)2、NaAlO2均既能和稀硫酸又能和氢氧化钠溶液反应 | |
| C. | Fe(OH)3、FeCl2、FeCl3均可通过化合反应得到 | |
| D. | 制备Fe(OH)2时加苯液封,同时将滴管插入苯层液面以下,其目的是防止Fe(OH)2被空气氧化 |
分析 A.常温下H2S与SO2反应生成硫单质和水,NO与O2反应生成二氧化氮,NH3与HCl反应生成白色固体氯化铵;
B.既能与稀硫酸反应又能与氢氧化钠溶液反应的物质有:两性化合物(如Al2O3、Al(OH)3等)、弱酸的铵盐(如(NH4)2CO3等)、弱酸的酸式盐(NaHCO3、NaHS等)、单质(如Al)、氨基酸等,据此解答;
C.氢氧化亚铁具有强的还原性,能够与氧气、水反应生成氢氧化铁,铁与氯化铁反应生成氯化亚铁,氯气具有强氧化性氧化变价金属为高价态化合物;
D.苯比水轻在水溶液中上层可以阻止氢氧化亚铁被空气中氧气氧化.
解答 解:A.常温下H2S与SO2反应生成硫单质和水,NO与O2反应生成二氧化氮,NH3与HCl反应生成白色固体氯化铵,H2S与SO2、NO与O2、NH3与HCl在常温下均不能大量共存,故A正确;
B.(NH4)2SO3是弱酸的铵盐,能和氢氧化钠反应,也能和稀硫酸反应,Ca(HCO3)2是弱酸酸式盐,能和氢氧化钠反应,也能和稀硫酸反应,NaAlO2是强碱弱酸盐和氢氧化钠溶液不反应,故B错误;
C.铁与氯气发生化合反应生成氯化铁,2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,铁与氯化铁发生反应生成氯化亚铁,2FeCl3+Fe=3FeCl2,氢氧化亚铁、氧气、水发生反应生成氢氧化铁,反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,都属于化合反应,故C正确;
D.制备Fe(OH)2时加苯液封,同时将滴管插入苯层液面以下,避免了空气中氧气进入,防止Fe(OH)2被空气氧化,能观察到白色沉淀,故D正确;
故选B.
点评 本题考查了二氧化硫、铵盐、铁及其化合物等物质性质的分析判断,主要是物质特征性质的理解应用,掌握基础是解题关键,题目难度中等.

| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,2.24LNO和2.24LO2混合气体分子数为0.15NA | |
| C. | 加热条件,1molFe投入足量的浓硫酸,生成NA个SO2分子 | |
| D. | 0.1molNa2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA |
| A. | 反应物和生成物的浓度改变 | B. | 反应体系的压强改变 | ||
| C. | 正、逆反应的速率改变 | D. | 反应物的转化率改变 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 甲烷分子的球棍模型: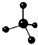 | ||
| C. | 乙醇的分子式:C2H5OH | D. | 氟离子的结构示意图: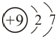 |
| A. | 1L水中溶解5.85gNaCl所形成溶液物质的量浓度是0.1mol•L-1 | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | 3.4gNH3中含N-H键数目为0.2NA |
| A. | O2[PtF6]中只含离子键 | B. | O2[PtF6]中氧元素化合价为+1 | ||
| C. | 反应中O2是氧化剂,PtF6是还原剂 | D. | 每生成1molO2PtF6转移1mol电子 |
| A. | 288 | B. | 208 | C. | 80 | D. | 128 |

| A. | X、Y、Z中Z的单质最稳定 | B. | Y的氢化物为H2Y | ||
| C. | H2Z能发生反应:Cl2+H2Z=Z+2HCl | D. | Y有含氧酸为HYO |
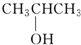 ⑨${\;}_{6}^{13}$C (填序号)
⑨${\;}_{6}^{13}$C (填序号)