题目内容
8.现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构.已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:
G$\stackrel{D的单质}{→}$P$\stackrel{D的单质}{→}$Q$\stackrel{H_{2}O}{→}$M+P
④E和D是同主族元素,氢化物(H2E)常温下为气态.
⑤B和D可形成个数比为1:1和2:1的离子化合物X和Y.
请回答下列问题:
(1)C元素在周期表的位置第二周期ⅤA族;化合物X所含化学键类型有离子键、共价键.
(2)用电子式表示Y的形成过程
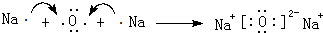 .
.(3)①A的氧化物与NaOH溶液反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O.
②M 的稀溶液与铜反应的化学方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O.
分析 现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
④E和D是同主族元素,氢化物(H2E)常温下为气态,则E是S元素,D是O元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G$\stackrel{D的单质}{→}$P$\stackrel{D的单质}{→}$Q$\stackrel{H_{2}O}{→}$M+P,则C是N元素,G为NH3,P为NO,Q为NO2,M为HNO3;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,X为Na2O2,Y为Na2O.
解答 解:现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构,
①常温下,F的单质是一种有色气体,常用于杀菌、消毒,则F是Cl元素;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸,则A是Al元素;
④E和D是同主族元素,氢化物(H2E)常温下为气态,则E是S元素,D是O元素;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:G$\stackrel{D的单质}{→}$P$\stackrel{D的单质}{→}$Q$\stackrel{H_{2}O}{→}$M+P,则C是N元素,G为NH3,P为NO,Q为NO2,M为HNO3;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y,则B是Na元素,X为Na2O2,Y为Na2O.
(1)C是N元素,N元素处于第二周期ⅤA族,X为Na2O2,含有离子键、共价键,
故答案为:第二周期ⅤA族;离子键、共价键;
(2)Y为Na2O,用电子式表示Na2O的形成过程: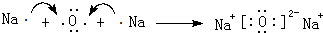 ,
,
故答案为: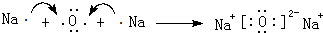 ;
;
(3)①A的氧化物是Al2O3,与NaOH溶液反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
②M为硝酸,M的稀溶液与铜反应的化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O.
点评 本题考查了元素化合物的性质,正确推断元素是解本题关键,注意掌握常见10电子微粒,注意对基础知识的理解掌握.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | 7s | B. | 2d | C. | 5f | D. | 6p |
| A. | H+、Na+、Cl-、ClO- | B. | K+、NO3-、Cl-、CO32- | ||
| C. | NH4+、Ca2+、OH-、HCO3- | D. | Al3+、NO3-、SO42-、MnO4- |
| A. | 化学反应的实质是旧化学键断裂和新化学键的形成 | |
| B. | 物质由高能量向低能量转化时,放出热量 | |
| C. | 将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多 | |
| D. | 干冰升华时放出大量的热 |
| A. | BF3 | B. | BeCl2 | C. | PC13 | D. | SO3 |
| 选项 | A | B | C | D |
| 装置 |  |  |  |  |
| 目的 | 快速制取少量HCl气体 | 测定不同浓度的H2O2溶液对产生O2速率的影响 | 制备并收集乙酸乙酯 | 从小苏打溶液中提取NaHCO3晶体 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 金刚石与碳纳米管互为同素异形体 | B. | N5与N2互为同素异形体 | ||
| C. | 14C的质子数为14 | D. | 乙醇和二甲醚属于同分异构体 |
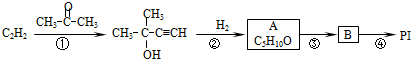
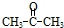 ”改为“乙醛”,经过②③④后得到产物的结构简式是
”改为“乙醛”,经过②③④后得到产物的结构简式是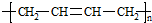 .
.

 +n NaOH→
+n NaOH→ +n CH3COONa.
+n CH3COONa.