题目内容
18.据报道,碳纳米管是碳原子形成的大分子,其导电性是铜的1万倍;N5可用作烈性炸药.下列说法不正确的是( )| A. | 金刚石与碳纳米管互为同素异形体 | B. | N5与N2互为同素异形体 | ||
| C. | 14C的质子数为14 | D. | 乙醇和二甲醚属于同分异构体 |
分析 AB.同一元素的不同单质互称同素异形体;C.质量数=质子数+中子数,质子数=原子序数;D.分子式相同,结构不同的互为同分异构体.
解答 解:A.金刚石与碳纳米管均是碳元素形成的不同种单质,互为同素异形体,故A正确;
B.N5和N2是氮元素的不同单质,所以N5和N2互为同素异形体,故B正确;
C.14C的质量数为14,质子数是6,故C错误;
D.乙醇和二甲醚分子式相同,结构不同,属于同分异构体,故D正确,故选C.
点评 本题主要考查的是同分异构体的概念以及同位素的概念,涉及质量数与质子数和中子数的关系,难度不大.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
9.甲学生对Cl2和FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是(用离子方程式表示)2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②通过实验证明了SCN- 中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
③若SCN-与Cl2反应生成1molCO2,则转移电子的物质的量是16mol.
| 操作 | 现象 |
通入氯气至过量 | Ⅰ、A中溶液变红 Ⅱ、稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是(用离子方程式表示)2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.
甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②通过实验证明了SCN- 中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
③若SCN-与Cl2反应生成1molCO2,则转移电子的物质的量是16mol.
6.下列说法中正确的是( )
| A. | 铝的第一电离能比镁的第一电离能大 | |
| B. | 钾的第一电离能比镁的第一电离能大 | |
| C. | 在所有的元素中,F的第一电离能最大 | |
| D. | 第3周期所含元素中钠的第一电离能最小 |
10.下列各组性质比较中,不正确的是( )
| A. | 元素最高化合价:Al>Mg | B. | 金属性:Al>Mg | ||
| C. | 酸性:H2SO4>H3PO4 | D. | 稳定性:HF>HCl |
7.化学与人类生活密切相关,下列说法不正确的是( )
| A. | 化学可以识别、改变和创造分子 | |
| B. | 金刚石常用作砂纸、砂轮的磨料 | |
| C. | 氧化铁常用作红色油漆和涂料 | |
| D. | 葡萄糖可用于合成补钙药物及维生素C(结构如图) |
8.下列化学反应的有机生成物为纯净物的是( )
| A. | CH4和Cl2光照发生取代反应 | |
| B. | 1,3丁二烯与等物质的量的溴发生反应 | |
| C. | CH3CH(OH)CH2CH3在浓硫酸作用下加热的反应 | |
| D. | 乙烯和氯化氢加成 |
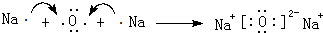 .
.

