题目内容
16.下列说法不正确的是( )| A. | 化学反应的实质是旧化学键断裂和新化学键的形成 | |
| B. | 物质由高能量向低能量转化时,放出热量 | |
| C. | 将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多 | |
| D. | 干冰升华时放出大量的热 |
分析 A、根据化学反应的实质分析判断.
B、物质由高能量向低能量转化时,放出热量;
C、将一定质量的C燃烧,生成CO2时比生成CO时放出的热量多;
D、干冰升华时吸收大量热量.
解答 解:A、化学反应的实质就是旧化学键的断裂和新化学键的形成,故A正确;
B、质由高能量向低能量转化时,放出热量,故B正确;
C、将一定质量的C燃烧,生成CO2时比生成CO时放出的热量,完全燃烧放出的热量多,故C正确;
D、干冰升华时吸收大量热量,故D错误.
故选:D.
点评 本题考查了化学反应的实质、吸放热反应的判断以及化学反应的意义等知识点,难度不大.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
6.下列转化关系不能通过一步反应直接完成的是( )
| A. | Cu→CuCl2 | B. | CuO→Cu2O | C. | Cu(OH)2→CuO | D. | CuO→Cu(OH)2 |
7.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )
| A. |  | B. |  | C. | CH3-CH=CH-CHO | D. |  |
4.下列操作过程中不能出现“先产生沉淀然后又完全溶解”现象的是( )
①CaCl2液中通入CO2至过量
②澄淸石灰水通入SO2至过量
③氢氧化铁胶体中滴加稀硫酸至过量
④FeCl3溶液中逐滴加人氢氡化钠溶液至过量.
①CaCl2液中通入CO2至过量
②澄淸石灰水通入SO2至过量
③氢氧化铁胶体中滴加稀硫酸至过量
④FeCl3溶液中逐滴加人氢氡化钠溶液至过量.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ④ |
11.氯气和漂白粉是现代工业和生活中常用的消毒液、杀菌剂.
(1)写出工业上用氯气和石灰乳制取漂白粉的化学方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(2)实验室有一瓶密封不严的漂白粉样品,其中一定含有CaCl2、Ca(OH)2,请设计实验,探究该样品中可能存在的其它固体物质
①提出合理假设
假设1:该漂白粉未变质,含Ca(ClO)2
假设2:该漂白粉全部变质,含CaCO3
假设3:该漂白粉部分变质,则含有CaCO3和Ca(ClO)3
②设计实验方案,进行实验,并完成实验报告.
(1)写出工业上用氯气和石灰乳制取漂白粉的化学方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(2)实验室有一瓶密封不严的漂白粉样品,其中一定含有CaCl2、Ca(OH)2,请设计实验,探究该样品中可能存在的其它固体物质
①提出合理假设
假设1:该漂白粉未变质,含Ca(ClO)2
假设2:该漂白粉全部变质,含CaCO3
假设3:该漂白粉部分变质,则含有CaCO3和Ca(ClO)3
②设计实验方案,进行实验,并完成实验报告.
| 实验步骤 | 预期现象和结论 | |
| ① | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再将产生的气体经蒸馏水、四氯化碳后导入澄清石灰水中 | a.若澄清石灰水未见浑浊,则假设1成立 b.若澄清石灰水变浑浊,则假设2或3成立 |
| ② | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再向试管中滴入1-2滴品红溶液,振荡 | 若品红褪色,结合实验①中的现象和结论b,则假设3 成立 |
1.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为0.2000mol/L.
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大.
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案用pH计(或精密pH试纸)测定相同浓度的醋酸在几种不同温度时的pH.
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.02 | 20.00 | 18.80 | 19.98 |
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大.
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案用pH计(或精密pH试纸)测定相同浓度的醋酸在几种不同温度时的pH.
5.在恒容密闭容器中,用铜铬的氧化物作催化剂,用一定量的HCl(g)和O2制取Cl2的原理为4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)+Q (Q>0 ).下列有关说法错误的是( )
| A. | 平衡前,随着反应的进行,容器内压强变小 | |
| B. | 平衡时,其他条件不变,分离出H2O(g),逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度平衡常数增大 | |
| D. | 其他条件不变,使用不同催化剂,HCl(g)的转化率不变 |
6.下列说法中正确的是( )
| A. | 铝的第一电离能比镁的第一电离能大 | |
| B. | 钾的第一电离能比镁的第一电离能大 | |
| C. | 在所有的元素中,F的第一电离能最大 | |
| D. | 第3周期所含元素中钠的第一电离能最小 |
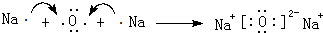 .
.