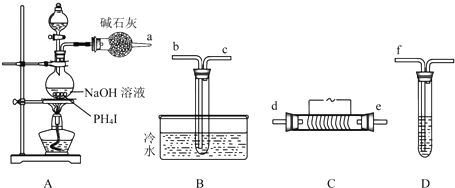
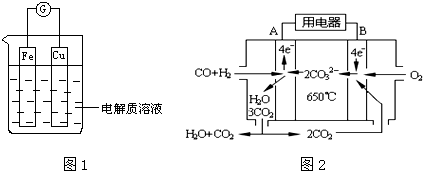
题目内容
18.将6.5g锌放入一定量稀硫酸中恰好完全反应,得到80mL密度为1.25g/mL的溶液.试计算:(1)生成标准状况下的H2多少升?
(2)所得溶液中硫酸锌的物质的量浓度
(3)若将该溶液与1mol/L的硫酸锌溶液等体积混合,则所得溶液中硫酸锌的物质的量浓度是多少?
(4)所用稀硫酸的质量分数.
分析 发生反应:Zn+H2SO4═ZnSO4+H2↑,根据方程式计算生成ZnSO4、H2的物质的量,H2SO4的质量.
(1)根据V=nVm计算氢气的体积;
(2)根据c=$\frac{n}{V}$计算硫酸锌的物质的量浓度;
(3)若将该溶液与1mol/L的硫酸锌溶液等体积混合,根据c=$\frac{n}{V}$计算硫酸锌的物质的量浓度;
(4)根据质量守恒定律计算原稀硫酸溶液的质量,进而计算稀硫酸的质量分数.
解答 解:设H2SO4的质量为m,生成ZnSO4、H2的物质的量分别为x、y,则:
Zn+H2SO4═ZnSO4+H2↑
65g 98g 1mol 1mol
6.5g m x y
故m=$\frac{6.5g×98g}{65g}$=9.8g
x=$\frac{6.5g×1mol}{65g}$=0.1mol
y=$\frac{6.5g×1mol}{65g}$=0.1mol
(1)标况下,生成氢气的体积为0.1mol×22.4L/mol=2.24L,答:生成氢气的体积为2.24L;
(2)硫酸锌的物质的量浓度为$\frac{0.1mol}{0.08L}$=1.25mol/L,答:硫酸锌溶液物质的量浓度为1.25mol/L;
(3)若将该溶液与1mol/L的硫酸锌溶液等体积混合,设体积都为1L,c=$\frac{n}{V}$=$\frac{1×1+1.25×1}{2L}$=1.125mol/L,答:所得溶液中硫酸锌的物质的量浓度是1.125mol/L;
(4)生成氢气的质量为0.1mol×2g/mol=0.2g,根据质量守恒,原稀硫酸的质量为80mL×1.25g/mL+0.2g-6.5g=93.7g,故稀硫酸的质量分数为$\frac{9.8g}{93.7g}$×100%=10.5%,答:稀硫酸的质量分数为10.5%.
点评 本题考查化学方程式计算、溶液浓度有关计算,难度不大,有利于基础知识的巩固.

| A. | 热稳定性H2O>H2S | B. | 还原性Ⅰ->Br->Cl- | ||
| C. | 金属性 K>Na | D. | 酸性 HCl>HF |
| A. | 溴苯和水 | B. | 溴乙烷和乙醇 | C. | 甘油和水 | D. | 溴苯和苯 |
| X | Y | |
| Z | W |
(1)元素Z位于周期表中第三周期VA族.
(2)Z、W形成的气态氢物的稳定性由强到弱顺序为H2S>PH3.(填化学式)
(3)XW2的化学式为CS2.
(4)Y的最高价氧化物的化学式为HNO3.
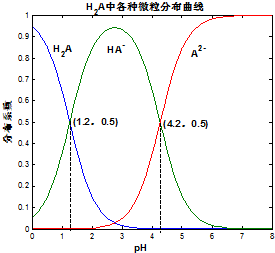 常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在 0.1mol/L NaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的 Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
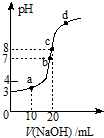 常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )
常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )| A. | a、b、c三点所示溶液导电能力最强的是c点对应的溶液 | |
| B. | 在c点溶液中:c(H+)+c(HA)=c(OH-) | |
| C. | 25℃,HA的电离平衡常数约为1.0×10-5 | |
| D. | a、b、c、d四点所示溶液中水的电离程度最大的是b点对应的溶液 |