题目内容
13.中国丝绸有五千年的历史和文化.古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮.这种“碱剂”可能是( )| A. | 食盐 | B. | 火碱 | C. | 草木灰 | D. | 胆矾 |
分析 由题意可知,该物质是一种盐,水溶液呈碱性,为强碱弱酸盐来解答.
解答 解:由题意可知,该物质是一种盐,水溶液呈碱性,为强碱弱酸盐
A.食盐中氯化钠为强酸强碱盐,故A错误;
B.火碱是氢氧化钠,属于碱,故B错误;
C.草木灰中碳酸钾强碱弱酸盐,故C正确;
D.胆矾是硫酸铜晶体,是强酸弱碱盐,故D错误;
故选C.
点评 本题主要考查了盐的性质,根据题目信息即可解答,难度不大.

练习册系列答案
相关题目
4. 苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
 苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中将氨基转化成硝基的反应为氧化反应 |
1.(Ⅰ)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
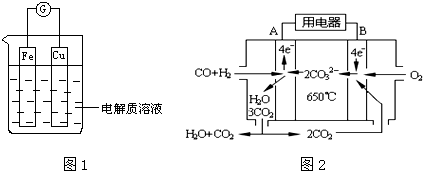
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图1:

在阳极区发生的反应包括4OH--4e-═2H2O+O2↑和H++HCO3-═H2O+CO2↑.用平衡原理简述CO32-在阴极区再生的过程HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移.
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol.
(3)在密闭的再生装置中,加入5mol H2与2mol CO2发生反应生成甲醇,反应达到平衡
时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图2所示,下列说法正确的是A C D
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1>T2>T3>T4
D.T4、P4、时,H2的平衡转化率为60%
(Ⅱ)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
①CH4和NO2反应正反应为放热反应(填“放热”或“吸热”);
②T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4.
③温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减少(填“增大”、“减小”或“不变”).
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图1:

在阳极区发生的反应包括4OH--4e-═2H2O+O2↑和H++HCO3-═H2O+CO2↑.用平衡原理简述CO32-在阴极区再生的过程HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移.
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol.
(3)在密闭的再生装置中,加入5mol H2与2mol CO2发生反应生成甲醇,反应达到平衡
时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图2所示,下列说法正确的是A C D
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1>T2>T3>T4
D.T4、P4、时,H2的平衡转化率为60%
(Ⅱ)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
| 时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | 0.5 | 0.5 |
②T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4.
③温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减少(填“增大”、“减小”或“不变”).
8.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 热稳定性H2O>H2S | B. | 还原性Ⅰ->Br->Cl- | ||
| C. | 金属性 K>Na | D. | 酸性 HCl>HF |
18.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24L乙醇分子所含的C-H键数为0.5NA | |
| B. | 3.2克O2和O3的混合气中含有的氧原子数目为0.2NA | |
| C. | 0.1mol•L-1的Al2(SO4)3溶液中,AL3+的数目小于0.2NA | |
| D. | 0.1molFe参加氧化还原反应,转移的电子数目一定是0.3NA |
2.(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下:
则X、Y、Z三种元素中原子半径最小的是Al(填元素符号),三种元素中有两种元素的最高价氧化物对应的水化物能相互反应,写出反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,分子间作用力大因而易液化.
②W分子的VSEPR模型的空间构型为四面体型.
③写出AB-离子的电子式:[:C??N:]-.
(3))E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E、F、G三元素的元素符号分别为K、、Cr、Cu.
②F元素在其化合物中最高化合价为+6.
③G2+离子的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9.G2+和N分子形成的配离子的结构式为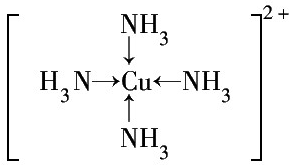 .
.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,分子间作用力大因而易液化.
②W分子的VSEPR模型的空间构型为四面体型.
③写出AB-离子的电子式:[:C??N:]-.
(3))E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E、F、G三元素的元素符号分别为K、、Cr、Cu.
②F元素在其化合物中最高化合价为+6.
③G2+离子的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9.G2+和N分子形成的配离子的结构式为
 .
.