题目内容
6.下列图示与对应的叙述相符合的是( )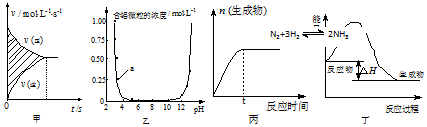
| A. | 图甲中阴影部分的面积表示v(正)与v (逆)的差值N2+3H2?2NH3 | |
| B. | 图乙表示溶液中含铝微粒浓度随pH变化曲线,a点所示溶液中存在大量AlO2- | |
| C. | 图丙表示一定条件下,该反应t时刻N2的转化率最大 | |
| D. | 图丁表示某吸热反应的能量变化 |
分析 A、图中阴影部分的面积为[c(反应物)-c (生成物)].
B、a点所示pH接近3,酸性环境中溶液中存在大量Al3+;
C、图丙表示反应物不断转化为生成物;
D、图丁反应物能量高,生成物能量低,此反应为放热反应.
解答 解:A、图中阴影部分的面积为[c(反应物)-c (生成物)],故A错误;
B、a点所示pH接近3,酸性环境中溶液中存在大量Al3+,故B错误;
C、图丙表示反应物不断转化为生成物,故该反应t时刻N2的转化率最大,故C正确;
D、图丁反应物能量高,生成物能量低,此反应为放热反应,故D错误,
故选C.
点评 本题考查了据图分析正逆反应速率变化图线、中和滴定中的pH变化、放热反应图象等,题目难度较大.

练习册系列答案
相关题目
16.下列有关物质性质与用途对应关系正确的是( )
| A. | 氧化镁熔点高,可用于制造耐高温材料 | |
| B. | 次氯酸有酸性,可用于自来水的杀菌消毒 | |
| C. | 油脂在碱性条件下水解,可用于制硬化油 | |
| D. | 晶体硅熔点高、硬度大,可用于制作半导体材料 |
17.元素周期律表明( )
| A. | 随着原子序数的增大,元素的主要化合价逐渐增加 | |
| B. | 随着随着相对原子质量的增大,元素的化学性质会不断重复 | |
| C. | 与碱金属相比,其相邻主族的(碱土)金属具有更小的密度和硬度 | |
| D. | 卤素氢化物的稳定性随着核电荷数的增加而减弱 |
14.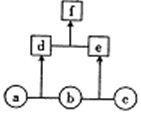 如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )
如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )
 如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )
如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )| A. | f受热易分解为d和e | |
| B. | 单质c具有强还原性 | |
| C. | 稳定性:d>e | |
| D. | 单质a中的元素在周期表中位于第二周期第ⅥA族 |
1.25℃时,1mol/L醋酸加水稀释至0.01mol/L,下列说法正确的是( )
| A. | 溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | B. | pH增大2个单位 | ||
| C. | 溶液中c(OH-)减小 | D. | Kw减小 |
3.关于下列图象及其相关说法正确的是( )
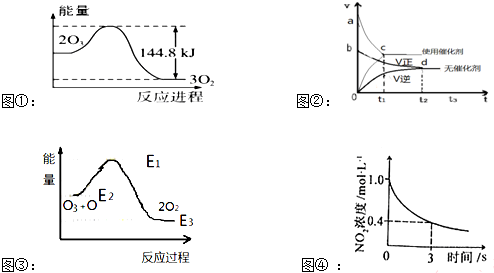

| A. | 据图①可判断:2O3(g)=3O2(g);△H=-44.8KJ/mol | |
| B. | 据图②可判断:某反应在使用催化剂时比无催化剂时反应速率大,且面积Saco>Sbdo | |
| C. | 据图③可判断:2O2(g)═O3(g)+O(g)△H>0 | |
| D. | 据图④可判断:2NO2(g)+O3(g)?N2O5(g)+O2(g),0~3s内,反应速率为V(N2O5)=0.2mol•L-1•S-1 |
7.下列关于环境问题的说法正确的是( )
| A. | 回收废旧电池的首要原因是回收石墨 | |
| B. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| C. | 焚烧一次性饭盒可减少白色污染 | |
| D. | 燃煤时加适量的生石灰可减少二氧化硫的排放 |
8.向盛有10mLlmol/LNH4Al(SO4)2溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图.下列有关说法正确的是( )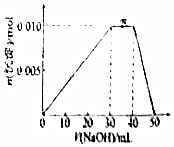

| A. | 当加入50mLNaOH时,溶液中的溶质为NaAlO2 | |
| B. | m点反应的离子方程式:NH4++OH-═NH3•H2O | |
| C. | NH4Al(SO4)2溶液中离子浓度由大到小的顺序是:c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 若向NH4Al(SO4)2溶液改加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.02mol |