题目内容
1.25℃时,1mol/L醋酸加水稀释至0.01mol/L,下列说法正确的是( )| A. | 溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | B. | pH增大2个单位 | ||
| C. | 溶液中c(OH-)减小 | D. | Kw减小 |
分析 A.加水稀释,溶液中的c(CH3COO-)减小,但醋酸的Ka不变;
B.加水稀释,醋酸的电离被促进;
C.对醋酸加水稀释,溶液中的氢离子浓度减小;
D.Kw只受温度的影响.
解答 解:A.加水稀释,溶液中的c(CH3COO-)减小,但醋酸的Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变,故溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大,故A正确;
B.加水稀释,醋酸的电离被促进,电离出的氢离子的物质的量增多,故pH的变化小于2,故B错误;
C.对醋酸加水稀释,溶液中的氢离子浓度减小,而Kw不变,故c(OH-)增大,故C错误;
D.Kw只受温度的影响,温度不变,Kw的值不变,故加水稀释对Kw的值无影响,故D错误.
故选A.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,明确影响电离平衡的因素为解答关键,注意水的离子积只受温度影响,为易错点,试题培养了稀释的分析能力及灵活应用能力.

练习册系列答案
相关题目
11. X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是
X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是
( )
 X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是
X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
| A. | 简单离子半径:W>Z>Y>X | B. | 简单氢化物稳定性:X>Z>W | ||
| C. | 制造镁合金时可以用X2作保护气 | D. | 化合物Y2Z2中存在离子键和共价键 |
12.下列化合物的分子中,所有原子都处于同一平面的有( )
| A. | 乙烷 | B. | 甲苯 | C. | ClO3- | D. | SO3 |
9.X、Y、Z、W是处于相邻短周期的不同主族元素.已知:四种元素的最外层电子数之和为13;X的单质常温下能与水剧烈反应;W的单质是黑火药的主要成分之一,它的一种氧化物有毒,易溶于水;Z的原子半径小于W;Z的最外层电子数是Y最外层电子数的2倍.下列说法正确的是( )
| A. | 含氧酸的酸性、氢化物的沸点:W>Z | |
| B. | 原子半径:X>Y>W | |
| C. | X的氢化物、X2W溶于水后所得溶液都呈碱性 | |
| D. | Z的最高价氧化物常用作光导纤维 |
16.常温下,在指定溶液中可以大量共存的离子是( )
| A. | 弱碱溶液中:Na+、K+、Cl-、HCO3- | |
| B. | 乙醇溶液中:K+、H+、SO42-、MnO4- | |
| C. | 中性溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| D. | 加入铝粉后有气体产生的溶液中:Na+、Mg2+、NO3-、Cl- |
6.下列图示与对应的叙述相符合的是( )
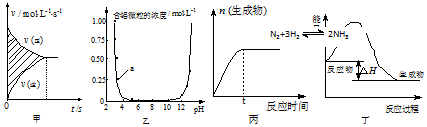

| A. | 图甲中阴影部分的面积表示v(正)与v (逆)的差值N2+3H2?2NH3 | |
| B. | 图乙表示溶液中含铝微粒浓度随pH变化曲线,a点所示溶液中存在大量AlO2- | |
| C. | 图丙表示一定条件下,该反应t时刻N2的转化率最大 | |
| D. | 图丁表示某吸热反应的能量变化 |
5. 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如实验数据:
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比;
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):反应II的△H2=+41.2kJ•mol-1.
在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的曲线)
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):反应II的△H2=+41.2kJ•mol-1.
在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的曲线)
3.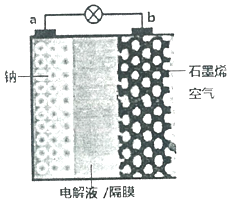 继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
 继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )| A. | a电极为负极 | |
| B. | Na+向b极移动 | |
| C. | a极发生氧化反应 | |
| D. | b电极的电极反应式:O2+2Na++4e-═Na2O2 |