题目内容
8.向盛有10mLlmol/LNH4Al(SO4)2溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图.下列有关说法正确的是( )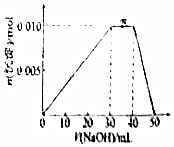
| A. | 当加入50mLNaOH时,溶液中的溶质为NaAlO2 | |
| B. | m点反应的离子方程式:NH4++OH-═NH3•H2O | |
| C. | NH4Al(SO4)2溶液中离子浓度由大到小的顺序是:c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 若向NH4Al(SO4)2溶液改加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.02mol |
分析 0-30mL时发生的反应为Al3++3OH-=Al(OH)3↓,30-40mL发生的离子方程式为NH4++OH-=NH3.H2O,40-50mL之间发生的离子方程式为 Al(OH)3+OH-=AlO2-+H2O,
A.当加入50mLNaOH时,溶液中的溶质为NaAlO2、NH3.H2O;
B.m点NaOH溶液体积在30-40mL之间,所以发生第二个离子方程式;
C.NH4Al(SO4)2溶液中铵根离子、铝离子都易发生水解反应,且铝离子水解程度大于铵根离子;
D.n[NH4Al(SO4)2]=1mol/L×0.01L=0.01mol、n[Ba(OH)2]=1.2mol/L×0.02L=0.024mol,而硫酸根离子的物质的量为0.02mol,而钡离子的物质的量为0.024mol,所以钡离子过量,硫酸根离子完全反应;又知0-40mL时铝离子和铵根离子消耗氢氧根离子的物质的量为0.04mol,而氢氧根离子的总物质的量是0.048mol,由此分析解答.
解答 解:0-30mL时发生的反应为Al3++3OH-=Al(OH)3↓,30-40mL发生的离子方程式为NH4++OH-=NH3.H2O,40-50mL之间发生的离子方程式为 Al(OH)3+OH-=AlO2-+H2O,
A.当加入50mLNaOH时,溶液中的溶质为NaAlO2、NH3.H2O,而不是单一的偏铝酸钠,故A错误;
B.m点NaOH溶液体积在30-40mL之间,所以发生第二个离子方程式,方程式为:NH4++OH-═NH3•H2O,故B正确;
C.NH4Al(SO4)2溶液中铵根离子、铝离子都易发生水解反应,且铝离子水解程度大于铵根离子,所以离子浓度由大到小的顺序是:c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-),故C错误;
D.n[NH4Al(SO4)2]=1mol/L×0.01L=0.01mol、n[Ba(OH)2]=1.2mol/L×0.02L=0.024mol,而硫酸根离子的物质的量为0.02mol,而钡离子的物质的量为0.024mol,所以钡离子过量,硫酸根离子完全反应,生成0.02mol硫酸钡;又知0-40mL时铝离子和铵根离子消耗氢氧根离子的物质的量为0.04mol,而氢氧根离子的总物质的量是0.048mol,此时溶解0.008mol的氢氧化铝,所以沉淀的物质的量为0.022mol,故D错误;
故选B.
点评 本题考查化学图象及离子方程式的计算,是对学生综合能力的考查,需要学生具备扎实的基础,明确离子反应的先后顺序是解题的关键,难度中等.

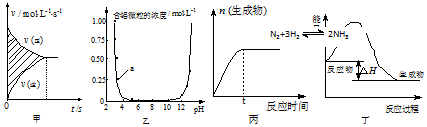
| A. | 图甲中阴影部分的面积表示v(正)与v (逆)的差值N2+3H2?2NH3 | |
| B. | 图乙表示溶液中含铝微粒浓度随pH变化曲线,a点所示溶液中存在大量AlO2- | |
| C. | 图丙表示一定条件下,该反应t时刻N2的转化率最大 | |
| D. | 图丁表示某吸热反应的能量变化 |
| A. | 化合物甲比乙的沸点低 | |
| B. | X、Y、Z、W的简单离子半径大小为:W>Y>Z>X | |
| C. | 丙属于正盐,其水溶液呈中性 | |
| D. | X和Z形成的二元化合物与乙的化学键类型相同 |
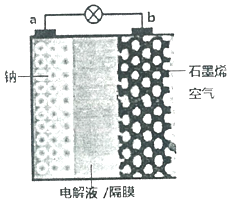 继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )
继锂电池之后,近几年科学家又研制出稳定性更高、电压损失更小的“钠--空气电池”.其反应原理是:2Na+O2=Na2O2,装置如图,其中电解液为NaPF6,可传导Na+.电池放电时,下列说法不正确的是( )| A. | a电极为负极 | |
| B. | Na+向b极移动 | |
| C. | a极发生氧化反应 | |
| D. | b电极的电极反应式:O2+2Na++4e-═Na2O2 |
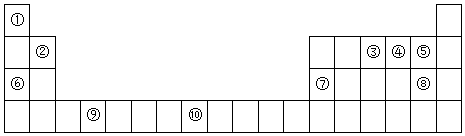
(1)元素⑩原子结构示意图为
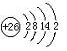 .
.(2)元素 ③④⑤的电负性由大到小的顺序为F>O>N(填化学用语,下同),其简单离子半径由大到小的顺序为N3->O2->F-.⑤与⑧气态氢化物中稳定性较强的是HF.
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式2OH-+BeO=BeO22-+H2O
(4)根据下列五种元素的第一至第四电离能数据(单位:KJ•mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(5)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.
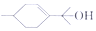 的说法不正确的是( )
的说法不正确的是( )| A. | 有机物的分子式是C10H18O | B. | 能与溴水、钠发生反应 | ||
| C. | 能发生氧化、取代反应 | D. | 与HC1发生加成的产物只有1种 |
| A. |  炸药爆炸 | B. |  溶洞形成 | C. |  铁桥生锈 | D. |  牛奶变质 |
| A. | 适当降低温度 | B. | 将锌粒改为铜粉 | ||
| C. | 将所用硫酸改为98.3%浓硫酸 | D. | 滴加少量CuSO4溶液 |
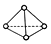 ,它是一种非极性分子.(填“极性”或“非极性”)
,它是一种非极性分子.(填“极性”或“非极性”)