题目内容
3.关于下列图象及其相关说法正确的是( )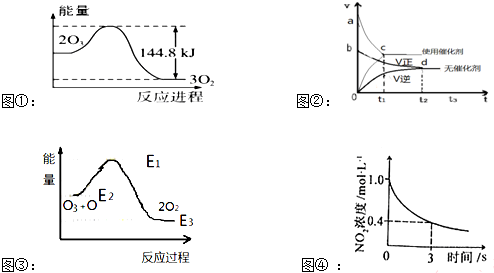
| A. | 据图①可判断:2O3(g)=3O2(g);△H=-44.8KJ/mol | |
| B. | 据图②可判断:某反应在使用催化剂时比无催化剂时反应速率大,且面积Saco>Sbdo | |
| C. | 据图③可判断:2O2(g)═O3(g)+O(g)△H>0 | |
| D. | 据图④可判断:2NO2(g)+O3(g)?N2O5(g)+O2(g),0~3s内,反应速率为V(N2O5)=0.2mol•L-1•S-1 |
分析 A.焓变等于生成物的总能量减去反应物的总能量;
B.催化剂只改变反应速率,不改变平衡移动;
C.由图可知,O+O3=2O2 的反应为放热反应,△H=E3-E2;
D.根据v=$\frac{△c}{△t}$进行计算求解.
解答 解:A.焓变等于生成物的总能量减去反应物的总能量,则根据图无法判断:2O3(g)=3O2(g)的焓变,故A错误;
B.催化剂只改变反应速率,不改变平衡移动,所以面积Saco=Sbdo,故B错误;
C.由图可知,反应物O和O3的能量高于产物2O2 的能量,所以反应为放热反应,△H=产物的焓-反应物的焓,即反应O+O3=2O2的△H=E3-E2,△H<0,则2O2(g)═O3(g)+O(g)为吸热反应,△H>0,故C正确;
D.0~3s内,反应速率为v(NO2)=$\frac{1-0.4}{3}$=0.2mol•L-1•s-1,2NO2(g)+O3(g)?N2O5(g)+O2(g),反应速率为V(N2O5)=$\frac{1}{2}$v(NO2)=0.1mol•L-1•S-1,故D错误;故选C.
点评 本题主要考查了根据图象判断反应的特征,侧重考查化学反应中能量变化、化学反应速率计算,中等难度,解题时要注意观察图以及基础原理的应用.

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
1.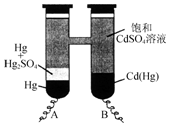 依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )
依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )
 依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )
依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )| A. | 电池工作时Cd2+向电极B移动 | |
| B. | 电极A上发生的反应:Hg2SO4+2e-═2Hg+SO42- | |
| C. | 电极B上发生的反应:Cd(Hg)-4e-═Hg2++Cd2+ | |
| D. | 反应中每生成a mol Hg转移3a mol电子 |
19.Na、Al、Fe都是重要的金属元素.下列说法正确的是( )
| A. | 氧化物都是碱性氧化物 | B. | 氢氧化物都是白色固体 | ||
| C. | 单质都可以与水反应 | D. | 单质在空气中都形成致密氧化膜 |
6.下列图示与对应的叙述相符合的是( )
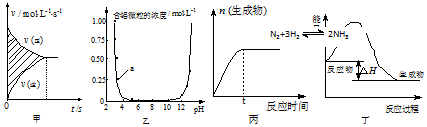

| A. | 图甲中阴影部分的面积表示v(正)与v (逆)的差值N2+3H2?2NH3 | |
| B. | 图乙表示溶液中含铝微粒浓度随pH变化曲线,a点所示溶液中存在大量AlO2- | |
| C. | 图丙表示一定条件下,该反应t时刻N2的转化率最大 | |
| D. | 图丁表示某吸热反应的能量变化 |
15.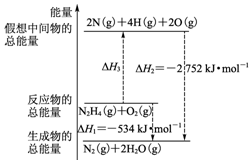 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:
火箭燃料肼(H2N-NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是( )
 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:| 化学键 | N-N | O=O | N≡N | N-H |
| 键能(kJ) | 154 | 500 | 942 | a |
| A. | N2比O2稳定 | |
| B. | N2H4(g)+O2(g)?N2(g)+2H2O(g)△H=-534 kJ•mol-1 | |
| C. | 表中的a=194 | |
| D. | 图中的△H3=+2218 kJ•mol-1 |
13.如图是元素周期表的一部分
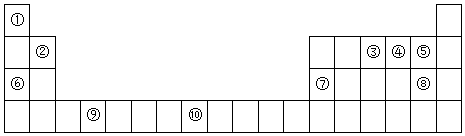
(1)元素⑩原子结构示意图为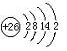 .
.
(2)元素 ③④⑤的电负性由大到小的顺序为F>O>N(填化学用语,下同),其简单离子半径由大到小的顺序为N3->O2->F-.⑤与⑧气态氢化物中稳定性较强的是HF.
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式2OH-+BeO=BeO22-+H2O
(4)根据下列五种元素的第一至第四电离能数据(单位:KJ•mol-1),回答下面各题:
①在周期表中,最可能处于同一主族的是R和U.(填元素代号)
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(5)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.

(1)元素⑩原子结构示意图为
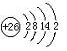 .
.(2)元素 ③④⑤的电负性由大到小的顺序为F>O>N(填化学用语,下同),其简单离子半径由大到小的顺序为N3->O2->F-.⑤与⑧气态氢化物中稳定性较强的是HF.
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式2OH-+BeO=BeO22-+H2O
(4)根据下列五种元素的第一至第四电离能数据(单位:KJ•mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(5)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.
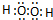 .
. ,用电子式表示A2C的形成过程.
,用电子式表示A2C的形成过程.