题目内容
14.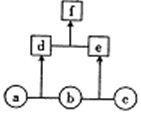 如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )
如图所示,a、b、c均为非金属单质;d、e均为10电子共价化合物,且分子中所含原子数:d>e;f为离子化合物.下列说法正确的是( )| A. | f受热易分解为d和e | |
| B. | 单质c具有强还原性 | |
| C. | 稳定性:d>e | |
| D. | 单质a中的元素在周期表中位于第二周期第ⅥA族 |
分析 a、b、c均为非金属单质,d、e均为10电子共价化合物,常见的10电子分子有CH4、NH3、H2O、HF,结合分子中所含原子数d>e及f为离子化合物可知,f为NH4F,则d为NH3,e为HF,a为N2,b为H2,c为F2,以此来解答.
解答 解:由上述分析可知,a为N2,b为H2,c为F2,d为NH3,e为HF,f为NH4F,
A.铵盐不稳定,加热易分解,结合氯化铵的性质可知,f受热易分解为d和e,故A正确;
B.c为F2,具有强氧化性,故B错误;
C.非金属性F>N,则稳定性:e>d,故C错误;
D.N原子结构中有2个电子层、最外层电子数为5,则单质a中的元素在周期表中位于第二周期第VA族,故D错误;
故选A.
点评 本题考查无机物的推断,为高频考点,把握常见的10电子微粒及f为铵盐为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.根据转化关系判断下列说法正确的是( )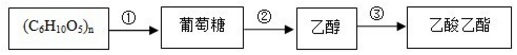

| A. | 反应②的反应类型属于分解反应 | |
| B. | (C6H10O5)n可以是淀粉或纤维素,二者互为同分异构体 | |
| C. | 将烧黑的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
5.A、B、C、D、E五种短周期元素,其中A是地壳中含量最多的元素;C元素的单质存在于火山喷发口附近或地壳的岩层里;E原子的电子总数等于其电子层数的3倍;D的一种原子核中没有中子;A、B、C三种元素的族序数之和为16.下列说法错误的是( )
| A. | D与E可形成既含极性键又含非极性键的分子 | |
| B. | B的最高价氧化物为酸性氧化物,不能与任何酸反应 | |
| C. | B、C、E三种元素的最高价氧化物对应的水化物中,B的酸性最弱 | |
| D. | A、C、D中两种或三种元素形成的钠盐溶液可显酸性、中性或碱性 |
9.X、Y、Z、W是处于相邻短周期的不同主族元素.已知:四种元素的最外层电子数之和为13;X的单质常温下能与水剧烈反应;W的单质是黑火药的主要成分之一,它的一种氧化物有毒,易溶于水;Z的原子半径小于W;Z的最外层电子数是Y最外层电子数的2倍.下列说法正确的是( )
| A. | 含氧酸的酸性、氢化物的沸点:W>Z | |
| B. | 原子半径:X>Y>W | |
| C. | X的氢化物、X2W溶于水后所得溶液都呈碱性 | |
| D. | Z的最高价氧化物常用作光导纤维 |
19.Na、Al、Fe都是重要的金属元素.下列说法正确的是( )
| A. | 氧化物都是碱性氧化物 | B. | 氢氧化物都是白色固体 | ||
| C. | 单质都可以与水反应 | D. | 单质在空气中都形成致密氧化膜 |
6.下列图示与对应的叙述相符合的是( )
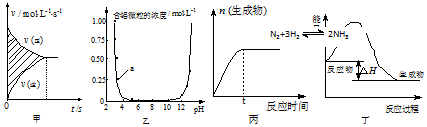

| A. | 图甲中阴影部分的面积表示v(正)与v (逆)的差值N2+3H2?2NH3 | |
| B. | 图乙表示溶液中含铝微粒浓度随pH变化曲线,a点所示溶液中存在大量AlO2- | |
| C. | 图丙表示一定条件下,该反应t时刻N2的转化率最大 | |
| D. | 图丁表示某吸热反应的能量变化 |
15.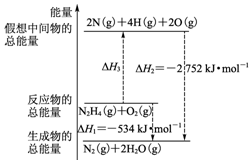 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:
火箭燃料肼(H2N-NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是( )
 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:| 化学键 | N-N | O=O | N≡N | N-H |
| 键能(kJ) | 154 | 500 | 942 | a |
| A. | N2比O2稳定 | |
| B. | N2H4(g)+O2(g)?N2(g)+2H2O(g)△H=-534 kJ•mol-1 | |
| C. | 表中的a=194 | |
| D. | 图中的△H3=+2218 kJ•mol-1 |
16.短周期元素X、Y、Z、W的原子序数依次增大;X与Y、W可分别形成10e-、18e-的化合物甲和化合物乙,甲为非电解质,乙为强电解质,甲与乙常温下可化合得到离子化合物丙.X、Y、Z的最外层电子数之和等于W的最外层电子数.则下列说法正确的是( )
| A. | 化合物甲比乙的沸点低 | |
| B. | X、Y、Z、W的简单离子半径大小为:W>Y>Z>X | |
| C. | 丙属于正盐,其水溶液呈中性 | |
| D. | X和Z形成的二元化合物与乙的化学键类型相同 |
 .
. ,用电子式表示A2C的形成过程.
,用电子式表示A2C的形成过程.