题目内容
按要求完成下列填空
(1)写出下列物质的电离方程式:Fe2(SO4)3 ,NaHCO3 ;
(2)写出下列反应的离子方程式:稀盐酸与碳酸钙反应 ,氢氧化钡溶液与稀硫酸反应 .
(1)写出下列物质的电离方程式:Fe2(SO4)3
(2)写出下列反应的离子方程式:稀盐酸与碳酸钙反应
考点:离子方程式的书写,电离方程式的书写
专题:离子反应专题,电离平衡与溶液的pH专题
分析:(1)硫酸铁为强电解质,溶液中完全电离出铁离子和硫酸根离子;碳酸氢钠为强电解质,溶液中完全电离出钠离子和碳酸氢根离子;
(2)碳酸钙与稀盐酸反应生成氯化钙和水;氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,据此写出反应的离子方程式.
(2)碳酸钙与稀盐酸反应生成氯化钙和水;氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,据此写出反应的离子方程式.
解答:
解:(1)硫酸铁在水溶液中完全电离,其电离方程式为:Fe2(SO4)3═2Fe3++3SO42-,碳酸氢钠为强电解质,其电离方程式为:NaHCO3═Na++HCO3-,
故答案为:Fe2(SO4)3═2Fe3++3SO42-;NaHCO3═Na++HCO3-;
(2)碳酸钙为难溶物,需要保留化学式,碳酸钙与稀盐酸反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O;氢氧化钡溶液与稀硫酸反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O.
故答案为:Fe2(SO4)3═2Fe3++3SO42-;NaHCO3═Na++HCO3-;
(2)碳酸钙为难溶物,需要保留化学式,碳酸钙与稀盐酸反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O;氢氧化钡溶液与稀硫酸反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O.
点评:本题考查了离子方程式、电离方程式的书写,题目难度中等,注意掌握离子方程式、电离方程式的书写方法,熟悉常见的难溶物、弱电解质、气体等.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A、溶液中导电能力增强 |
| B、溶液中c(H+)/c(CH3COOH)增大 |
| C、醋酸的电离程度增大,c(H+)亦增大 |
| D、电离平衡左移 |
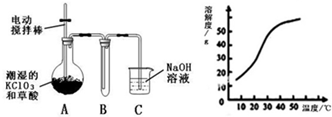 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.

 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题:
,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题: