题目内容
 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.(1)利用“化学蒸气转移法”提纯金属钨的反应原理为
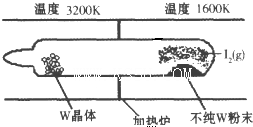
W(s)+I2(g)?WI2(g)(I).该反应在石英真空管中进行,如图所示:
①反应(I)的平衡常数表达式K=
| 1 |
| 2 |
②反应(I)的△H
③能够说明上述反应已经达到平衡状态的有
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等.
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol?L-1,则该温度下H2SO3?HSO3-+H+的电离常数Ka=
c(S
| ||
c(HS
|
(3)直接排放含SO2的烟气会形成酸雨,危害环境.用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
考点:化学平衡的计算,化学平衡状态的判断
专题:化学平衡专题
分析:(1)①平衡常数指一定条件下,可逆反应达到平衡时,生成物浓度化学计量数次数幂之积与反应物浓度化学计量数次数幂之积的比值,注意固体、纯液体不需要写出;
令平衡时,参加反应I2的物质的量为xmol,利用三段式表示出平衡时各物质的物质的量,反应前后气体的化学计量数不变,用物质的量代替浓度代入平衡常数表达式列方程计算;
②由图可知,在高温条件下得到纯的W晶体,即升高温度平衡向逆反应方向移动;反应体系中I2可循环使用;
③当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断,注意选择的物理量随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(2)由HSO3-+H2O?H2SO3+OH-、H2SO3?HSO3-+H+的平衡常数表达式,可以推知H2SO3的电离常数Ka=
;
若向H2SO3溶液中加入少量的I2,I2与H2SO3反应生成H2SO4与HI,溶液酸性增强,c(H+)增大,由HSO3-?SO32-+H+可知
=
,温度不变,Ka2不变,据此判断;
(3)由表中数据可知,溶液中n(SO32-):n(HSO3-)=1:1时,溶液pH=7.2,且比值越大,溶液的碱性越强,故吸收液呈中性时应n(SO32-):n(HSO3-)<1:1,溶液呈中性有c(H-)=c(OH-),结合电荷守恒有c(Na+)=2c(SO32-)+c(HSO3-),据此判断.
令平衡时,参加反应I2的物质的量为xmol,利用三段式表示出平衡时各物质的物质的量,反应前后气体的化学计量数不变,用物质的量代替浓度代入平衡常数表达式列方程计算;
②由图可知,在高温条件下得到纯的W晶体,即升高温度平衡向逆反应方向移动;反应体系中I2可循环使用;
③当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断,注意选择的物理量随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(2)由HSO3-+H2O?H2SO3+OH-、H2SO3?HSO3-+H+的平衡常数表达式,可以推知H2SO3的电离常数Ka=
| Kw |
| Kh |
若向H2SO3溶液中加入少量的I2,I2与H2SO3反应生成H2SO4与HI,溶液酸性增强,c(H+)增大,由HSO3-?SO32-+H+可知
c(S
| ||
c(HS
|
| Ka2 |
| c(H+) |
(3)由表中数据可知,溶液中n(SO32-):n(HSO3-)=1:1时,溶液pH=7.2,且比值越大,溶液的碱性越强,故吸收液呈中性时应n(SO32-):n(HSO3-)<1:1,溶液呈中性有c(H-)=c(OH-),结合电荷守恒有c(Na+)=2c(SO32-)+c(HSO3-),据此判断.
解答:
解:(1)①可逆反应W(s)+I2(g)?WI2(g)的平衡常数k=
,
令平衡时,转化的I2的物质的量为x,则:
W(s)+I2(g)?WI2(g)
开始(mol):1 0
变化(mol):x x
平衡(mol):1-x x
反应前后气体的化学计量数不变,可以用物质的量代替浓度计算平衡常数,故
=
,解得x=
,故反应达到平衡时I2(g)的转化率为=
×100%=33.3%,
故答案为:
;33.3%;
②由图可知,在高温条件下得到纯的W晶体,即升高温度平衡向逆反应方向移动,正反应为放热反应,即△H<0;反应体系中I2可循环使用,
故答案为:<;I2;
③a.平衡时I2与WI2浓度关系与转化率有关,二者浓度不一定相等,故a错误;
b.随反应进行,W质量分数变化,若W的质量不再变化,说明到达平衡,故b正确;
c.随反应进行,混合气体的质量发生变化,恒容条件下密度也在不断变化,若容器内混合气体的密度保持不变,说明反应达到平衡,故c正确;
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等,都表示的正反应速率,不能说明达到平衡,故d错误,
故答案为:bc;
(2)由HSO3-+H2O?H2SO3+OH-、H2SO3?HSO3-+H+的平衡常数表达式,可以推知H2SO3的电离常数Ka=
=
mol?L-1=10-2mol?L-1,;
若向H2SO3溶液中加入少量的I2,I2与H2SO3反应生成H2SO4与HI,溶液酸性增强,c(H+)增大,由HSO3-?SO32-+H+(电离平衡常数设为Ka2)可知
=
,温度不变,Ka2不变,故
减小,
故答案为:10-2;减小;
(3)由表中数据可知,溶液中n(SO32-):n(HSO3-)=1:1时,溶液pH=7.2,且比值越大,溶液的碱性越强,故吸收液呈中性时应n(SO32-):n(HSO3-)<1:1,即c(HSO3-)>c(SO32-),溶液呈中性有c(H-)=c(OH-),结合电荷守恒推出c(Na+)=2c(SO32-)+c(HSO3-),故溶液中c(Na+)>c(HSO3-),所以溶液中c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-).
| c(WI2) |
| c(I2) |
令平衡时,转化的I2的物质的量为x,则:
W(s)+I2(g)?WI2(g)
开始(mol):1 0
变化(mol):x x
平衡(mol):1-x x
反应前后气体的化学计量数不变,可以用物质的量代替浓度计算平衡常数,故
| x |
| 1-x |
| 1 |
| 2 |
| 1 |
| 3 |
| ||
| 1mol |
故答案为:
| c(WI2) |
| c(I2) |
②由图可知,在高温条件下得到纯的W晶体,即升高温度平衡向逆反应方向移动,正反应为放热反应,即△H<0;反应体系中I2可循环使用,
故答案为:<;I2;
③a.平衡时I2与WI2浓度关系与转化率有关,二者浓度不一定相等,故a错误;
b.随反应进行,W质量分数变化,若W的质量不再变化,说明到达平衡,故b正确;
c.随反应进行,混合气体的质量发生变化,恒容条件下密度也在不断变化,若容器内混合气体的密度保持不变,说明反应达到平衡,故c正确;
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等,都表示的正反应速率,不能说明达到平衡,故d错误,
故答案为:bc;
(2)由HSO3-+H2O?H2SO3+OH-、H2SO3?HSO3-+H+的平衡常数表达式,可以推知H2SO3的电离常数Ka=
| Kw |
| Kh |
| 10-14 |
| 1.0×10-12 |
若向H2SO3溶液中加入少量的I2,I2与H2SO3反应生成H2SO4与HI,溶液酸性增强,c(H+)增大,由HSO3-?SO32-+H+(电离平衡常数设为Ka2)可知
c(S
| ||
c(HS
|
| Ka2 |
| c(H+) |
c(S
| ||
c(HS
|
故答案为:10-2;减小;
(3)由表中数据可知,溶液中n(SO32-):n(HSO3-)=1:1时,溶液pH=7.2,且比值越大,溶液的碱性越强,故吸收液呈中性时应n(SO32-):n(HSO3-)<1:1,即c(HSO3-)>c(SO32-),溶液呈中性有c(H-)=c(OH-),结合电荷守恒推出c(Na+)=2c(SO32-)+c(HSO3-),故溶液中c(Na+)>c(HSO3-),所以溶液中c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-).
点评:本题考查化学平衡常数、化学平衡计算、弱电解质的电离平衡常数、溶液离子浓度大小比较,侧重考查学生对知识迁移运用能力,注意比较溶液中各种离子浓度相对大小时要结合电荷守恒和物料守恒等分析解答,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化.①~⑧为各装置中的电极编号.下列说法错误的是( )
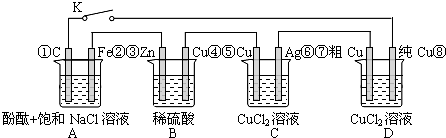

| A、当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 |
| B、当K断开时,B装置锌片溶解,有氢气产生 |
| C、当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② |
| D、当K闭合后,A、B装置中pH变大,C、D装置中pH不变 |

 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题:
,它可通过不同化学反应分别制得B、C和D三种物质.回答下列问题:


