题目内容
某校化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习.
I.查阅资料,获取了相关知识信息:
金属的活泼性不同,其硝酸盐分解产物不同,依据金属活动顺序表:
(1)K→Na等活泼金属的硝酸盐分解生成亚硝酸盐和氧气,如:2NaNO3
2NaNO2+O2↑;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2,如:2Cu(NO3)2
2CuO+4NO2↑+O2↑;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2,如:2AgNO3
2Ag+2NO2↑+O2↑.
Ⅱ.实验探究,在实验的基础上得到相关结论:
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将Fe(NO3)2热分解固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验.
(1)提出猜想:猜想一:Fe元素只显+2价;
猜想二:Fe元素只显 价;
猜想三:Fe元素 .
(2)实验操作:①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入 溶液.
(3)实验现象:实验① ;实验②溶液不褪色.
(4)实验结论:猜想二成立,Fe(NO3)2分解的化学方程式是 .
【实验二】探究Fe(NO3)2热分解气体产物的性质.小组乙、丙同学进行了如图所示的实验(收集时操作恰当,几乎没有空气):
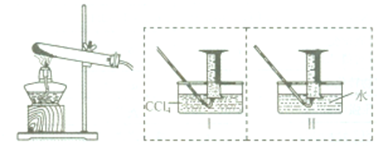
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管中,并重新连接好仪器;④加热;⑤…
(1)乙同学使用工装置收集气体,恰好收集到54mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是 .
(2)丙同学取等质量的Fe(NO3)2同样条件下热分解,并使用Ⅱ装置收集气体产物,可收集到 mL气体.
【实验三】探究固体混合物的组成和特征.
(1)小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是 (填字母序号).
A.1:2:3 B.2:1:3 C.l:2:2 D.3:8:5
(2)若取按上述比例混合的固体硝酸盐1mol溶于100mL 3mol?L-1的硫酸中,再向溶液中加入铜片,可溶解的铜的最大质量为 g.
I.查阅资料,获取了相关知识信息:
金属的活泼性不同,其硝酸盐分解产物不同,依据金属活动顺序表:
(1)K→Na等活泼金属的硝酸盐分解生成亚硝酸盐和氧气,如:2NaNO3
| ||
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2,如:2Cu(NO3)2
| ||
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2,如:2AgNO3
| ||
Ⅱ.实验探究,在实验的基础上得到相关结论:
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将Fe(NO3)2热分解固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验.
(1)提出猜想:猜想一:Fe元素只显+2价;
猜想二:Fe元素只显
猜想三:Fe元素
(2)实验操作:①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入
(3)实验现象:实验①
(4)实验结论:猜想二成立,Fe(NO3)2分解的化学方程式是
【实验二】探究Fe(NO3)2热分解气体产物的性质.小组乙、丙同学进行了如图所示的实验(收集时操作恰当,几乎没有空气):

实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管中,并重新连接好仪器;④加热;⑤…
(1)乙同学使用工装置收集气体,恰好收集到54mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是
(2)丙同学取等质量的Fe(NO3)2同样条件下热分解,并使用Ⅱ装置收集气体产物,可收集到
【实验三】探究固体混合物的组成和特征.
(1)小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是
A.1:2:3 B.2:1:3 C.l:2:2 D.3:8:5
(2)若取按上述比例混合的固体硝酸盐1mol溶于100mL 3mol?L-1的硫酸中,再向溶液中加入铜片,可溶解的铜的最大质量为
考点:性质实验方案的设计
专题:实验设计题
分析:【实验一】
(1)Fe是典型的变价金属,有+2价、+3价,分解后,Fe可能只显+2价,可能只显+3价,也可能既有+2价也有+3价;
(2)检验铁离子用KSCN溶液,观察是否溶液变红,检验亚铁离子可用酸性KMnO4稀溶液,观察KMnO4溶液是否褪色;
(3)若猜想二成立,铁元素只显+3价,则在溶液中加入KSCN溶液,溶液应变红,向另一份溶液中滴入酸性KMnO4稀溶液,KMnO4溶液颜色无明显变化;
(4)猜想二成立,Fe(NO3)2热分解生成了氧化铁,二氧化氮和氧气,方程式:4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑;
【实验二】
(1)由于NO2和的密度均大于空气,所以将量筒从水槽中取出,正放在试验台上;
(2)由4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑可知产生NO2和O2的体积比为8:1,而4NO2~O2可恰好进入溶液中,剩余的NO2溶于水产生NO,因此收集到的气体为NO;
【实验三】
(1)根据三个反应2KNO3
2KNO2↑+O2↑;2Cu(NO3)2
2CuO+4NO2↑+O2↑; 2Fe(NO3)2
Fe2O3+8NO2↑+O2↑,混合粉末充分加热后用排水法未收集到任何气体,说明三个反应中生成的气体物质的量之比n(NO2):n(O2)=4:1,通过选项答案验证;
(2)按C选项,KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比1:2:2,则1 mol混合物中,n(NO3-)=(0.2+0.4×2+0.4×2)mol=1.8mol,根据3Cu~2NO3-~8H+关系计算Cu的质量.
(1)Fe是典型的变价金属,有+2价、+3价,分解后,Fe可能只显+2价,可能只显+3价,也可能既有+2价也有+3价;
(2)检验铁离子用KSCN溶液,观察是否溶液变红,检验亚铁离子可用酸性KMnO4稀溶液,观察KMnO4溶液是否褪色;
(3)若猜想二成立,铁元素只显+3价,则在溶液中加入KSCN溶液,溶液应变红,向另一份溶液中滴入酸性KMnO4稀溶液,KMnO4溶液颜色无明显变化;
(4)猜想二成立,Fe(NO3)2热分解生成了氧化铁,二氧化氮和氧气,方程式:4Fe(NO3)2
| ||
【实验二】
(1)由于NO2和的密度均大于空气,所以将量筒从水槽中取出,正放在试验台上;
(2)由4Fe(NO3)2
| ||
【实验三】
(1)根据三个反应2KNO3
| ||
| ||
| ||
(2)按C选项,KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比1:2:2,则1 mol混合物中,n(NO3-)=(0.2+0.4×2+0.4×2)mol=1.8mol,根据3Cu~2NO3-~8H+关系计算Cu的质量.
解答:
解:【实验一】
(1)Fe是典型的变价金属,有+2价、+3价,分解后,Fe可能只显+2价,可能只显+3价,也可能既有+2价也有+3价,
故答案为:+3;既有+2价又有+3价;
(2)检验铁离子用KSCN溶液,观察是否溶液变红,检验亚铁离子可用酸性KMnO4稀溶液,观察KMnO4溶液是否褪色,
故答案为:酸性高锰酸钾;
(3)若猜想二成立,铁元素只显+3价,则在溶液中加入KSCN溶液,溶液应变红,向另一份溶液中滴入酸性KMnO4稀溶液,KMnO4溶液颜色无明显变化,
故答案为:溶液呈血红色;
(4)猜想二成立,Fe(NO3)2热分解生成了氧化铁,二氧化氮和氧气,方程式:4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑,
故答案为:4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑;
【实验二】
(1)将收集气体的量筒从水槽中取出的方法是用玻璃片在水槽里盖好量筒口,用食指摁紧玻璃片,由于NO2和的密度均大于空气,所以将量筒从水槽中取出,正放在试验台上,
故答案为:用玻璃片在水槽里盖好量筒口,用食指摁紧玻璃片,将量筒从水槽中取出,正放在试验台上;
(2)若用排水法收集时,4NO2~O2可恰好进入溶液中,由4Fe(NO3)2
2Fe2O3+8NO2↑+O2↑可知产生NO2和O2的体积比为8:1,则54ml气体中有24ml NO2和6ml O2恰好进入溶液,另外24ml NO2溶于水产生8ml NO,则收集到的气体为8ml 气体,
故答案为:8;
【实验三】(1)根据三个反应2KNO3
2KNO2↑+O2↑;2Cu(NO3)2
2CuO+4NO2↑+O2↑; 2Fe(NO3)2
Fe2O3+8NO2↑+O2↑,混合粉末充分加热后用排水法未收集到任何气体,说明三个反应中生成的气体物质的量之比n(NO2):n(O2)=4:1,Cu(NO3)2受热分解的气体产物恰好符合物质的量之比n(NO2):n(O2)=4:1,所以其量为任意值,而KNO3和2Fe(NO3)2按物质的量比为1:2混合受热分解的气体恰好符合n(NO2):n(O2)=4:1进入溶液,
故答案为:C;
(2)按C选项,KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比1:2:2,则1 mol混合物中,n(NO3-)=(0.2+0.4×2+0.4×2)mol=1.8mol,
溶于硫酸溶液后和Cu反应,设能溶解Cu的质量为x,则
3Cu~2NO3-~8H+
192g 2mol 8mol
x 1.8mol 0.6mol
x=
×192g=14.4g,
故答案为:14.4.
(1)Fe是典型的变价金属,有+2价、+3价,分解后,Fe可能只显+2价,可能只显+3价,也可能既有+2价也有+3价,
故答案为:+3;既有+2价又有+3价;
(2)检验铁离子用KSCN溶液,观察是否溶液变红,检验亚铁离子可用酸性KMnO4稀溶液,观察KMnO4溶液是否褪色,
故答案为:酸性高锰酸钾;
(3)若猜想二成立,铁元素只显+3价,则在溶液中加入KSCN溶液,溶液应变红,向另一份溶液中滴入酸性KMnO4稀溶液,KMnO4溶液颜色无明显变化,
故答案为:溶液呈血红色;
(4)猜想二成立,Fe(NO3)2热分解生成了氧化铁,二氧化氮和氧气,方程式:4Fe(NO3)2
| ||
故答案为:4Fe(NO3)2
| ||
【实验二】
(1)将收集气体的量筒从水槽中取出的方法是用玻璃片在水槽里盖好量筒口,用食指摁紧玻璃片,由于NO2和的密度均大于空气,所以将量筒从水槽中取出,正放在试验台上,
故答案为:用玻璃片在水槽里盖好量筒口,用食指摁紧玻璃片,将量筒从水槽中取出,正放在试验台上;
(2)若用排水法收集时,4NO2~O2可恰好进入溶液中,由4Fe(NO3)2
| ||
故答案为:8;
【实验三】(1)根据三个反应2KNO3
| ||
| ||
| ||
故答案为:C;
(2)按C选项,KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比1:2:2,则1 mol混合物中,n(NO3-)=(0.2+0.4×2+0.4×2)mol=1.8mol,
溶于硫酸溶液后和Cu反应,设能溶解Cu的质量为x,则
3Cu~2NO3-~8H+
192g 2mol 8mol
x 1.8mol 0.6mol
x=
| 0.6mol |
| 8nol |
故答案为:14.4.
点评:本题考查了铁及其重要化合物的性质实验方案设计,侧重于离子检验、设计实验方案及操作、混合物的计算,综合性较强,难度较大,计算Cu的质量时注意硝酸根离子是过量的.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
向NaAlO2溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气体是( )
| A、NO2 |
| B、CO2 |
| C、NH3 |
| D、CO |
从铝土矿制备铝所涉及的反应中,不属于离子反应的是( )
| A、铝土矿溶于NaOH溶液中 |
| B、NaAlO2溶液的酸化 |
| C、灼烧氢氧化铝固体 |
| D、电解熔融的氧化铝 |
在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),达到平衡时,生成了2molC,经测定D的浓度为0.5mol?L-1下列判断正确的是( )
| A、x=1 |
| B、达到平衡时,在相同温度下容器内混合气体的压强是反应前的8.5倍 |
| C、平衡时A的浓度为1.50?L-1 |
| D、B的转化率为20% |
下列有关物质用途的说法中错误的是( )
| A、热的纯碱溶液可以去除油污 |
| B、金属钠可以从硫酸铜溶液中置换出铜 |
| C、碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一 |
| D、镁燃烧发出耀眼的白光,常用来制造信号弹和焰火 |
 运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.
运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.