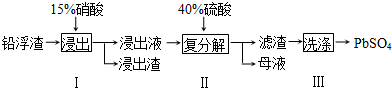
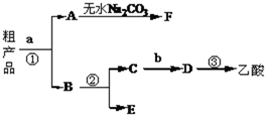
题目内容
向NaAlO2溶液中持续通入一种气体,开始时产生沉淀,随后沉淀又逐渐溶解,该气体是( )
| A、NO2 |
| B、CO2 |
| C、NH3 |
| D、CO |
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:偏铝酸钠是强碱弱酸盐,能和酸反应生成氢氧化铝沉淀,氢氧化铝是两性氢氧化物能和强酸或强碱反应生成可溶性的盐.
解答:
解:A.NO2通入溶液时先与水反应生成硝酸,偏铝酸钠和硝酸反应时,开始时产生氢氧化铝沉淀,氢氧化铝能和硝酸反应生成可溶性的硝酸铝,所以沉淀又能溶解,故A正确;
B.二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀,但氢氧化铝不能溶于弱酸,所以沉淀不溶解,故B错误;
C.氨气和偏铝酸钠不反应,故C错误;
D.一氧化氮和偏铝酸钠不反应,故D错误;
故选A.
B.二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀,但氢氧化铝不能溶于弱酸,所以沉淀不溶解,故B错误;
C.氨气和偏铝酸钠不反应,故C错误;
D.一氧化氮和偏铝酸钠不反应,故D错误;
故选A.
点评:本题考查了偏铝酸钠、氢氧化铝的性质,注意氢氧化铝能溶于强碱或强酸,但不溶于弱酸或弱碱,为易错点.

练习册系列答案
相关题目
下列有关物质性质、应用的说法中不正确的是( )
| A、Al2O3既能溶于NaOH溶液又能溶于HCl,说明Al2O3是两性氧化物 |
| B、浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 |
| C、SO2气体具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D、石英的主要成分是SiO2 |
下列关于原子结构、元素性质及元素周期表的结构的说法正确的是( )
| A、元素周期表中位于金属和非金属非界线附近的元素属于过渡元素 |
| B、短周期元素中,元素符号用一个大写英文字母表示的元素共有7种 |
| C、第三周期元素的最高正化合价等于它所处的主族序数 |
| D、共价化合物中各原子都一定满足最外层8电子稳定结构 |
 实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:
实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题: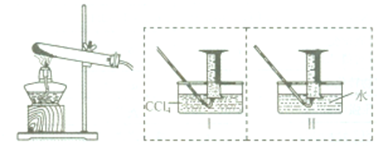
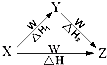 X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是①C、CO ②AlCl3、Al(OH)3③Fe、Fe(NO3)2④Na2CO3、NaHCO3( )
X、Y、Z、W四种物质之间有如图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式△H=△H1+△H2.则X、Y可能是①C、CO ②AlCl3、Al(OH)3③Fe、Fe(NO3)2④Na2CO3、NaHCO3( )