题目内容
下列说法正确的是( )
| A、BeCl2分子中各原子最外层均已满足8电子稳定结构 |
| B、第ⅡA族的某元素原子序数为x,则原子序数为x+1的元素不一定在第ⅢA族 |
| C、构成单质分子的粒子间一定存在化学键 |
| D、含有离子键的化合物不一定是离子化合物 |
考点:原子核外电子排布,元素周期表的结构及其应用,共价键的形成及共价键的主要类型,不同晶体的结构微粒及微粒间作用力的区别
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、BeCl2分子中Be的L层上的2个电子分别于Cl的一个电子形成共用电子对;
B、在第ⅡA族和第ⅢA族之间有过渡元素的存在;
C、单原子分子不存在化学键;
D、由阴、阳离子相互作用而构成的化合物,这就叫做离子化合物.
B、在第ⅡA族和第ⅢA族之间有过渡元素的存在;
C、单原子分子不存在化学键;
D、由阴、阳离子相互作用而构成的化合物,这就叫做离子化合物.
解答:
解:A、BeCl2分子中BeL层的2个电子分别于Cl的一个电子形成共用电子对,因此Cl达到了8电子稳定结构,Be为2+2=4个电子达不到8电子稳定结构,故A错误;
B、由于在第ⅡA族和第ⅢA族之间有过渡元素的存在,原子序数为x+1的元素也可能为第ⅢB族元素,故B正确;
C、化学键指原子间强烈的作用力,故单原子分子不存在化学键,例如稀有气体,故C错误;
D、阴、阳离子之间的静电作用力成为离子键,含有离子键的化合物一定是离子化合物,因此离子化合物一定含有离子键,有些还含有共价键,如氯化铵,故D错误.
故选:B.
B、由于在第ⅡA族和第ⅢA族之间有过渡元素的存在,原子序数为x+1的元素也可能为第ⅢB族元素,故B正确;
C、化学键指原子间强烈的作用力,故单原子分子不存在化学键,例如稀有气体,故C错误;
D、阴、阳离子之间的静电作用力成为离子键,含有离子键的化合物一定是离子化合物,因此离子化合物一定含有离子键,有些还含有共价键,如氯化铵,故D错误.
故选:B.
点评:本题考查“位构性”、化学键及离子化合物、共价化合物,需掌握:当一种化合物同时含有离子键和共价键时,此化合物为离子化合物,共价化合物只含有共价键,子化合物一定含有离子键,有些还含有共价键.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
原子核外每个电子层上均含有2n2个电子的元素是( )
| A、Be | B、C | C、Ar | D、Ne |
下列对电负性的理解不正确的是( )
| A、电负性是人为规定的一个相对数值,不是绝对标准 |
| B、元素电负性的大小反映了元素对键合电子引力的大小 |
| C、元素的电负性越大,则元素的非金属性越强 |
| D、元素的电负性是元素固有的性质,与原子结构无关 |
下列研究分析方法正确的是( )
| A、分别测定SO2、CO2饱和溶液的PH,可比较H2SO3、H2CO3二酸的强弱 |
| B、先滴入少量氯水,后滴入KSCN试液,可确定溶液中是否含Fe2+ |
| C、25℃若测知氨水与NH4Cl混合溶液的pH>7,可确定溶液中c(NH4+)>c(Cl-) |
| D、固体NH2COONH4(s)在密闭容器中存在:NH2COONH4(s)?2NH3(g)+CO2(g)△S>0,由此可确定反应的△H<0 |
下列各基态原子和离子的电子排布式错误的是( )
| A、Ca2+ 1s22s22p63s23p6 |
| B、F- 1s22s23p6 |
| C、S2- 1s22s22p63s23p4 |
| D、Ar 1s22s22p63s23p6 |
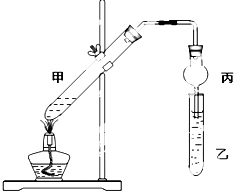 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓慢加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸.将试管甲固定在铁架台上,在试管乙中加入5mL饱和碳酸钠溶液,按如图连接好装置进行实验,当试管乙中有明显现象时停止实验.