题目内容
(1)1gN2中含a个分子,则阿伏伽德罗常数可以表示为
(2)现由58.5g质量分数为20%的NaCl溶液100mL
①NaCI的物质的量为
②溶液中NaCI的物质的量浓度为
(3)把下列物质按原子个数由小到大的顺序排序
①17gNH3②标准状况下22.4LCH4③NA个CH3CH2OH④含1mol的H2SO4
(4)配制950mL物质的量浓度为0.5mol/LCuSO4溶液,选用 mL的容量瓶,称取 gCuSO4?5H2O来配制.
(2)现由58.5g质量分数为20%的NaCl溶液100mL
①NaCI的物质的量为
②溶液中NaCI的物质的量浓度为
(3)把下列物质按原子个数由小到大的顺序排序
①17gNH3②标准状况下22.4LCH4③NA个CH3CH2OH④含1mol的H2SO4
(4)配制950mL物质的量浓度为0.5mol/LCuSO4溶液,选用
考点:物质的量的相关计算
专题:计算题
分析:利用n=
来计算物质的量,再利用N=n×NA来计算微粒个数.根据c=
计算NaCl的物质的量浓度,结合n=
计算物质的量,原子的物质的量越大,其数目越多.
| m |
| M |
| n |
| V |
| V |
| Vm |
解答:
解:(1)氮气的摩尔质量为28g/mol,
则1g氮气的物质的量为
=
mol,
由N=n×NA,则阿伏加德罗常数为
=28amol-1,故答案为:28a;
(2)现由58.5g质量分数为20%的NaCl溶液100mL
①NaCl物质的量为n=
=
=0.2mol,
故答案为:0.2mol;
②溶液中NaCI的物质的量浓度c=
=
=2mol/L,故答案为:2mol/L;
(3)①n(NH3)=
=1mol,原子的物质的量为1mol×4=4mol;
②标准状况下22.4LCH4,CH4的物质的量为
=1mol,原子的物质的量为1mol×5=5mol;
③NA个CH3CH2OH物质的量为1mol,原子的物质的量为1mol×9=9mol;
④含1mol的H2SO4,原子的物质的量为1mol×7=7mol;
故答案为:①<②<④<③;
(4)容量瓶的规格有四种:100mL、250mL、500mL、1000mL,故选择1000mL的容量瓶,
需硫酸铜晶体的质量为m=1L×0.5mol?L-1×250g/mol=125g.
故答案为:1000;125.
则1g氮气的物质的量为
| 1g |
| 28g/mol |
| 1 |
| 28 |
由N=n×NA,则阿伏加德罗常数为
| a | ||
|
(2)现由58.5g质量分数为20%的NaCl溶液100mL
①NaCl物质的量为n=
| m |
| M |
| 58.5g×20% |
| 58.5g/mol |
故答案为:0.2mol;
②溶液中NaCI的物质的量浓度c=
| n |
| V |
| 0.2mol |
| 0.1L |
(3)①n(NH3)=
| 17g |
| 17g/mol |
②标准状况下22.4LCH4,CH4的物质的量为
| 22.4L |
| 22.4L/mol |
③NA个CH3CH2OH物质的量为1mol,原子的物质的量为1mol×9=9mol;
④含1mol的H2SO4,原子的物质的量为1mol×7=7mol;
故答案为:①<②<④<③;
(4)容量瓶的规格有四种:100mL、250mL、500mL、1000mL,故选择1000mL的容量瓶,
需硫酸铜晶体的质量为m=1L×0.5mol?L-1×250g/mol=125g.
故答案为:1000;125.
点评:本题考查阿伏伽德罗常数的计算,较简单,明确质量、物质的量、微粒数目的关系即可解答.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
某学生在实验室制取乙酸乙酯(反应温度80℃左右)和乙酸丁酯(反应温度115~125℃),现有两套实验装置图Ⅰ和图Ⅱ.下列说法错误的是( )
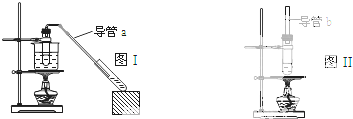

| A、制乙酸乙酯用图I装置,制乙酸丁酯用图II 装置 |
| B、导管a和导管b的作用都是冷凝回流 |
| C、都可用Na2CO3 溶液来洗去酯中的酸和醇 |
| D、加入过量的乙酸可以提高醇的转化率 |
下列说法正确的是( )
| A、BeCl2分子中各原子最外层均已满足8电子稳定结构 |
| B、第ⅡA族的某元素原子序数为x,则原子序数为x+1的元素不一定在第ⅢA族 |
| C、构成单质分子的粒子间一定存在化学键 |
| D、含有离子键的化合物不一定是离子化合物 |
下列说法错误的是( )
| A、向某溶液加入盐酸酸化的BaCl2溶液,若生成白色沉淀,则原溶液中一定含有SO42 |
| B、向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
| C、向FeSO4溶液中加入NaOH,可以看到先出现白色沉淀,迅速变为灰绿色,最终变成红褐色 |
| D、不能用澄清的石灰水来鉴别Na2CO3和NaHCO3溶液 |
 【物质结构域性质】
【物质结构域性质】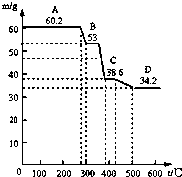 某校研究性学习小组取得了两种牌号的水滑石样品拟进行探究,请回答相关问题.
某校研究性学习小组取得了两种牌号的水滑石样品拟进行探究,请回答相关问题.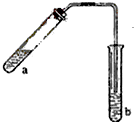 哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空: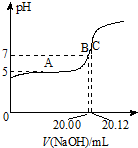 CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.
CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.