题目内容
下列研究分析方法正确的是( )
| A、分别测定SO2、CO2饱和溶液的PH,可比较H2SO3、H2CO3二酸的强弱 |
| B、先滴入少量氯水,后滴入KSCN试液,可确定溶液中是否含Fe2+ |
| C、25℃若测知氨水与NH4Cl混合溶液的pH>7,可确定溶液中c(NH4+)>c(Cl-) |
| D、固体NH2COONH4(s)在密闭容器中存在:NH2COONH4(s)?2NH3(g)+CO2(g)△S>0,由此可确定反应的△H<0 |
考点:常见阳离子的检验,反应热和焓变,盐类水解的应用
专题:
分析:A、依据二氧化硫与二氧化碳的溶解度不同,故不能依据饱和溶液确定亚硫酸与碳酸的强弱;
B、氯水具有强氧化性,可以氧化Fe2+生成Fe3+,据此解答即可;
C、pH>7,故c(OH-)>c(H+),依据电荷守恒解答即可;
D、熵增是自发进行的反应,据此反应不能判定焓变.
B、氯水具有强氧化性,可以氧化Fe2+生成Fe3+,据此解答即可;
C、pH>7,故c(OH-)>c(H+),依据电荷守恒解答即可;
D、熵增是自发进行的反应,据此反应不能判定焓变.
解答:
解:A、二氧化硫与二氧化碳的溶解度不同,不能依据饱和溶液确定亚硫酸与碳酸的强弱,故A错误;
B、先滴加氯水,氯气将Fe2+氧化成Fe3+,即使原溶液不含Fe3+,滴加KSCN溶液后也显红色,无法证明原溶液是否含有Fe3+,故B错误;
C、溶液中存在:c(NH4+)+c(H+)=c(OH-)+c(Cl-),因为c(OH-)>c(H+),所以c(NH4+)>c(Cl-),故C正确;
D、氨基甲酸铵在真空容器中的分解反应为NH2COONH4(s)?2NH3(g)+CO2(g),则该反应发生后气体物质的量增大,所以混乱度增大,即△S>0,不能判定△H的变化,故D错误,
故选C.
B、先滴加氯水,氯气将Fe2+氧化成Fe3+,即使原溶液不含Fe3+,滴加KSCN溶液后也显红色,无法证明原溶液是否含有Fe3+,故B错误;
C、溶液中存在:c(NH4+)+c(H+)=c(OH-)+c(Cl-),因为c(OH-)>c(H+),所以c(NH4+)>c(Cl-),故C正确;
D、氨基甲酸铵在真空容器中的分解反应为NH2COONH4(s)?2NH3(g)+CO2(g),则该反应发生后气体物质的量增大,所以混乱度增大,即△S>0,不能判定△H的变化,故D错误,
故选C.
点评:本题主要考查了铁离子、亚铁离子的检验方法、弱酸酸性强弱的比较、盐类的水解、焓变的判断,题目难度不大,注意明确滴加氧化剂、KSCN溶液的顺序不能颠倒,如果颠倒,无法确定溶原液将中是否含有Fe2+.

练习册系列答案
相关题目
下列说法正确的是( )
| A、BeCl2分子中各原子最外层均已满足8电子稳定结构 |
| B、第ⅡA族的某元素原子序数为x,则原子序数为x+1的元素不一定在第ⅢA族 |
| C、构成单质分子的粒子间一定存在化学键 |
| D、含有离子键的化合物不一定是离子化合物 |
鲍林的电负性是以最活泼的非金属元素作为标度计算出来的,该元素是( )
| A、氧 | B、氯 | C、氟 | D、硫 |
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
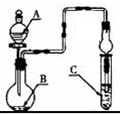

| A、若A为浓硫酸,B为铜,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C、若A为浓盐酸,B为MnO2,C中盛KI-淀粉溶液,则C中溶液变蓝 |
| D、若A为水,B为Na2O2固体,C中盛氢硫酸溶液,则C中溶液变浑浊 |
下列说法错误的是( )
| A、向某溶液加入盐酸酸化的BaCl2溶液,若生成白色沉淀,则原溶液中一定含有SO42 |
| B、向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
| C、向FeSO4溶液中加入NaOH,可以看到先出现白色沉淀,迅速变为灰绿色,最终变成红褐色 |
| D、不能用澄清的石灰水来鉴别Na2CO3和NaHCO3溶液 |
已知某元素+3价离子的电子排布为:1s22s22p63s23p63d5,该元素在周期表中的位置正确的是( )
| A、第三周期Ⅷ族,p区 |
| B、第三周期ⅤB族,ds区 |
| C、第四周期Ⅷ族,d区 |
| D、第四周期ⅤB族,f区 |
下列分子中所有原子都满足最外层8电子结构的是( )
| A、光气(COCl2) |
| B、五氯化磷(PCl5) |
| C、氟利昂(CF2Cl2) |
| D、三氟化硼(BF3) |
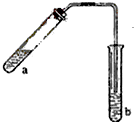 哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
哈三中某化学课外学习小组利用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空: