题目内容
20.测定中和热的实验所用NaOH溶液要稍过量的原因确保定量的HCl反应完全;倒入NaOH溶液的正确操作是C(填序号).A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入.
分析 为了确保定量的HCl反应完全,所用NaOH稍过量;为了减少能量损失,一次迅速倒入NaOH溶液.
解答 解:实验中,所用NaOH稍过量的原因是确保定量的HCl反应完全;为了减少能量损失,一次迅速倒入NaOH溶液.
故答案为:确保定量的HCl反应完全;C.
点评 本题考查了中和热的测定方法,题目难度中等,明确中和热的测定原理为解答关键,注意掌握中和热计算方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
10.若取等质量的铝粉分别与足量的稀盐酸和NaOH溶液反应,所得氢气的体积在同样条件下相比( )
| A. | 与酸反应产生氢气多 | B. | 与碱反应产生氢气多 | ||
| C. | 一样多 | D. | 不知道铝粉的质量,无法比较 |
15.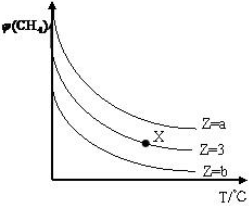 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )| A. | 该反应的焓变△H>0 | |
| B. | 图中Z的大小为b>3>a | |
| C. | 图中X点对应的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 温度不变时,图中X点对应的平衡在加压后φ(CH4)增大 |
5.下列各组物质:①NaCl和NaNO3②CaCO3和BaCl2③KCl和MnO2④BaSO4和AgCl按溶解、过滤、蒸发的操作顺序能将它们一一分离的是( )
| A. | 只有① | B. | ③和④ | C. | ②和③ | D. | 只有③ |
5.下列关于硬水及其软化的说法正确的是( )
| A. | 软水是不含Ca2+、Mg2+的水 | |
| B. | 石灰-纯碱法中石灰是指CaCO3 | |
| C. | 石灰-纯碱法软化硬水过程中,Mg2+引起的硬度转化成了Ca2+的硬度 | |
| D. | 离子交换剂不能再生 |
2.已知常温下:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述正确的是( )
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
3.在一定条件下,向一体积为2L的恒容密闭容器中充入2mol A、1mol B,发生反应:2A(g)+B(g)?3C(g)△H=-Q kJ/mol(Q>0).经过60s达到平衡,测得B的物质的量为0.4mol,下列对该平衡的叙述正确的是( )
| A. | 用C表示该反应的速率为0.03mol/(L•s) | |
| B. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| C. | 若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变 | |
| D. | 若升高温度,则V (逆)增大,V(正)减小,平衡逆向移动 |