题目内容
15.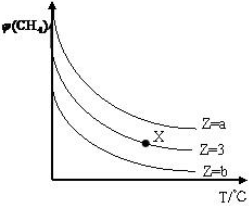 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )| A. | 该反应的焓变△H>0 | |
| B. | 图中Z的大小为b>3>a | |
| C. | 图中X点对应的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 温度不变时,图中X点对应的平衡在加压后φ(CH4)增大 |
分析 A、温度越高CH4的体积分数越小;
B、水蒸气的量越多,CH4的转化率越大,平衡时CH4的体积分数越小;
C、X点对应起始的量,而不是平衡时;
D、增大压强,平衡逆向移动.
解答 解:A、温度越高CH4的体积分数越小,说明平衡正向移动,所以正反应是吸热,所以该反应的焓变△H>0,故A正确;
B、水蒸气的量越多,CH4的转化率越大,平衡时CH4的体积分数越小,所以Z的大小为b>3>a,故B正确;
C、X点对应起始的量之比,而不是平衡时,故C错误;
D、增大压强,平衡逆向移动,所以平衡在加压后φ(CH4)增大,故D正确;
故选C.
点评 本题考查了化学平衡的影响因素及应用,题目难度不大,明确化学平衡及其影响为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
5.为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
6.下列说法中,正确的是( )
| A. | 卤族元素单质X2(X代表F、Cl、Br、I)均可以与水反应生成HX | |
| B. | 高纯度的硅单质用于制作光导纤维 | |
| C. | 将SO2通入次氯酸钙溶液可得到次氯酸 | |
| D. | 氢氧化铁溶于氢碘酸的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O |
3.处处留心皆知识.生活中遇到下列问题,不涉及到化学变化的是( )
| A. | 食物腐败变质 | B. | 浓硫酸在空气中体积增大 | ||
| C. | 铝表面形成致密的薄膜 | D. | 食醋洗掉水垢 |
7.在一定条件下,将A2和B2两种气体通入1L密闭容器中,发生反应:xA2(g)+yB2(g)?2C(g),2S内的反应速率:V (A2)=0.5mol•L-1•s-1,V (B2)=1.5mol•L-1•s-1,V (C)=1mol•L-1•s-1 则x和y的值分别为( )
| A. | 2和3 | B. | 3和2 | C. | 3和1 | D. | 1和3 |
17.下列叙述中不正确的是( )
| A. | 向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaOH饱和溶液,又有CaCO3沉淀生成 | |
| B. | 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 | |
| C. | 等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积前者多 | |
| D. | 向Na2CO3饱和溶液中通CO2,有NaHCO3结晶析出 |
18.恒容密闭容器中,某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验1,反应在前20min内用B的浓度变化来表示的平均速率为0.009mol/(L•min).
(2)在实验2,A的初始浓度c2=1.0mol/L,反应在 20分钟内就达到平衡,可推测实验2中还隐含的条件是加入催化剂.
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1(用同种物质的浓度变化表示),则达到平衡时υ3>υ1(填>、=、<=)且c3=1.2 mol/L.
(4)比较实验4和实验1,可推测该反应是吸热反应(选填“吸热”、“放热”).
(5)800℃时,反应2A?B+D的平衡常数=0.25,实验2中达到平衡时A的转化率=50%.
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 | 800℃ | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
(1)在实验1,反应在前20min内用B的浓度变化来表示的平均速率为0.009mol/(L•min).
(2)在实验2,A的初始浓度c2=1.0mol/L,反应在 20分钟内就达到平衡,可推测实验2中还隐含的条件是加入催化剂.
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1(用同种物质的浓度变化表示),则达到平衡时υ3>υ1(填>、=、<=)且c3=1.2 mol/L.
(4)比较实验4和实验1,可推测该反应是吸热反应(选填“吸热”、“放热”).
(5)800℃时,反应2A?B+D的平衡常数=0.25,实验2中达到平衡时A的转化率=50%.
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题: