题目内容
甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等,也是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:室内甲醛含量不得超过0.08mg/m3
(1)某研究性学习小组拟用甲醛法测定常见铵态氮肥的含氮量[资料:4NH4++6HCHO=(CH2)6N4H++3H++6H2O,所生成的H+和(CH2)6N4H+可用NaOH标准溶液滴定,采用酚酞作指示剂].用甲醛法测定含氮量,不适合的铵盐是 .(填字母)
a.NH4HCO3 b.(NH4)2SO4 c.NH4Cl
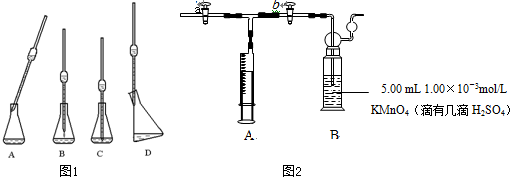
(2)滴定时取待测液于锥形瓶中,操作如图所示(手持部分省略):正确的操作是如图1 ,取溶液所用仪器的名称是 .
(3)工业制甲醛的两种方法如下(数据均为298.15K下测定):
反应I:CH3OH(g)→HCHO(g)+H2(g)
△H1=+92.09kJ/mol,K1=3.92×10-11
反应II:CH3OH(g)+
O2(g)→HCHO(g)+H2O(g)
△H2=-149.73kJ/mol,K2=4.35×1029
①绿色化学提倡化工生产应提高原子利用率.反应 (填“I”或“II”)制甲醛原子利用率更高.从反应的焓变和平衡常数K值看,反应 (填“I”或“II”)制甲醛更加有利.
②反应Ⅱ自发进行的条件是 .
a.高温b.低温c.任何条件都自发
(4)某研究性学习小组测定居室中甲醛的含量的原理如下,请结合已学知识,配平下列方程式:
MnO4-+ HCHO+ = Mn2++ CO2↑+
打开a,关闭b,用注射器抽取室内空气;关闭b,打开a,再推动注射器,将气体全部推入酸性KMnO4溶液中,使其充分反应.当B装置中 时停止推气.若总共取样为500L空气,则该居室内空气中甲醛的浓度 mg/m3.
(1)某研究性学习小组拟用甲醛法测定常见铵态氮肥的含氮量[资料:4NH4++6HCHO=(CH2)6N4H++3H++6H2O,所生成的H+和(CH2)6N4H+可用NaOH标准溶液滴定,采用酚酞作指示剂].用甲醛法测定含氮量,不适合的铵盐是
a.NH4HCO3 b.(NH4)2SO4 c.NH4Cl
(2)滴定时取待测液于锥形瓶中,操作如图所示(手持部分省略):正确的操作是如图1
(3)工业制甲醛的两种方法如下(数据均为298.15K下测定):
反应I:CH3OH(g)→HCHO(g)+H2(g)
△H1=+92.09kJ/mol,K1=3.92×10-11
反应II:CH3OH(g)+
| 1 |
| 2 |
△H2=-149.73kJ/mol,K2=4.35×1029
①绿色化学提倡化工生产应提高原子利用率.反应
②反应Ⅱ自发进行的条件是
a.高温b.低温c.任何条件都自发
(4)某研究性学习小组测定居室中甲醛的含量的原理如下,请结合已学知识,配平下列方程式:
打开a,关闭b,用注射器抽取室内空气;关闭b,打开a,再推动注射器,将气体全部推入酸性KMnO4溶液中,使其充分反应.当B装置中

考点:探究物质的组成或测量物质的含量
专题:
分析:(1)根据HCO3-也可与NaOH标准溶液反应;
(2)根据向锥形瓶中取液的基本实验操作判断;取液用的是移液管;
(3)①根据原子利用率表示目标产物的质量与生成物总质量之比来比较;根据平衡常数越大越有利于反应的进行;
②反应放热,且熵值增大,根据△G=△H-T?△S判断;
(4)根据氧化还原反应中化合价升降相等配平该反应的离子方程式;根据恰好反应进行完,酸性KMnO4溶液颜色褪去;根据化学方程式4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O求出HCHO的物质的量,然后求出其体积,最后求出甲醛的浓度.
(2)根据向锥形瓶中取液的基本实验操作判断;取液用的是移液管;
(3)①根据原子利用率表示目标产物的质量与生成物总质量之比来比较;根据平衡常数越大越有利于反应的进行;
②反应放热,且熵值增大,根据△G=△H-T?△S判断;
(4)根据氧化还原反应中化合价升降相等配平该反应的离子方程式;根据恰好反应进行完,酸性KMnO4溶液颜色褪去;根据化学方程式4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O求出HCHO的物质的量,然后求出其体积,最后求出甲醛的浓度.
解答:
解;(1)因HCO3-也可与NaOH标准溶液反应,消耗NaOH标准溶液,使得测定结果偏高,故选:a;
(2)图中所用的仪器是移液管,将移液管放入接受溶液的容器中,使出口尖端靠着容器内壁,容器稍倾斜,移液管则保持垂直,放开食指,使溶液沿容器内壁自然流下,待移液管内溶液流凈后,再等待15秒,取出移液管,留在管口的少量液体不要吹出,
故答案是:D;移液管;
(3)①因原子利用率表示目标产物的质量与生成物总质量之比,反应I的原子利用率为
×100%=93.7%,反应II的原子利用率为
×100%=62.5%;平衡常数越大越有利于反应的进行;故答案为:I;II;
②因反应放热,△H<0,熵值增大,△S>0,所以△G=△H-T?△S一定小于0,反应自发,故选:c;
(4)由上述反应,高锰酸根离子中Mn元素化合价由+7变为+2,化合价降低了5价,反应中高锰酸根离子被还原,则HCHO中的C在反应中被氧化,HCHO中C的化合价为0价,被氧化成二氧化碳气体,化合价升高至少升高4价,化合价变化的最小公倍数为20,则高锰酸根离子化学计量数为4,HCHO的计量数为5,然后利用电荷守恒及观察法配平其它物质,配平后的反应方程式为:4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O;恰好反应进行完,酸性KMnO4溶液颜色褪去,
4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O
4 5
5×10-3 L×1.00×10-4mol/L n
n=6.25×10-7mol
则HCHO的质量为6.25×10-7mol×30g/mol=1.5×10-5g=1.875×10-2mg,空气的体积为50L=0.05m3,室内空气中甲醛的浓度
=0.375 mg/m3,故答案为:4;5;12H+;4;5;11H2O;酸性KMnO4溶液颜色突然褪去;0.375.
(2)图中所用的仪器是移液管,将移液管放入接受溶液的容器中,使出口尖端靠着容器内壁,容器稍倾斜,移液管则保持垂直,放开食指,使溶液沿容器内壁自然流下,待移液管内溶液流凈后,再等待15秒,取出移液管,留在管口的少量液体不要吹出,
故答案是:D;移液管;
(3)①因原子利用率表示目标产物的质量与生成物总质量之比,反应I的原子利用率为
| 30 |
| 32 |
| 30 |
| 48 |
②因反应放热,△H<0,熵值增大,△S>0,所以△G=△H-T?△S一定小于0,反应自发,故选:c;
(4)由上述反应,高锰酸根离子中Mn元素化合价由+7变为+2,化合价降低了5价,反应中高锰酸根离子被还原,则HCHO中的C在反应中被氧化,HCHO中C的化合价为0价,被氧化成二氧化碳气体,化合价升高至少升高4价,化合价变化的最小公倍数为20,则高锰酸根离子化学计量数为4,HCHO的计量数为5,然后利用电荷守恒及观察法配平其它物质,配平后的反应方程式为:4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O;恰好反应进行完,酸性KMnO4溶液颜色褪去,
4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O
4 5
5×10-3 L×1.00×10-4mol/L n
n=6.25×10-7mol
则HCHO的质量为6.25×10-7mol×30g/mol=1.5×10-5g=1.875×10-2mg,空气的体积为50L=0.05m3,室内空气中甲醛的浓度
| 1.875×10 -2mg |
| 0.05m 3 |
点评:本题主要考查了甲醛的性质、制备,同时考查了实验,难度不大,知识点较多,有一定的难度.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
同温同压下,同体积的CO和CO2,下列说法不正确的是( )
| A、分子数之比等于1:1 |
| B、原子数之比等于3:2 |
| C、质量之比等于7:11 |
| D、质子数之比等于7:11 |
下列反应中可判断为可逆反应的是( )
| A、氢气和氯气点燃生成氯化氢,氯化氢受热分解为氢气和氯气 |
| B、氮气和氢气在高温、高压、催化剂作用下可以生成氨气,同时氨气又分解为氮气和氢气 |
| C、单质溴可以置换出碘,氯气又可以置换出溴 |
| D、氯气和水反应生成盐酸和次氯酸,次氯酸光照条件下可分解为盐酸和氧气 |
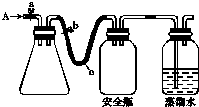 实验室用下列方法测定某水样中O2的含量.
实验室用下列方法测定某水样中O2的含量.