题目内容
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍.试回答:
(1)这四种元素分别是:A ,B ,C ,D .
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是 .
(3)A与B形成的三原子分子的结构式是 ,B与D形成的原子个数比为1:1的化合物的电子式是 .
(4)用电子式表示D2B的形成过程: .
(1)这四种元素分别是:A
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是
(3)A与B形成的三原子分子的结构式是
(4)用电子式表示D2B的形成过程:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,据此解答该题.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,据此解答该题.
 ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,据此解答该题.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,据此解答该题.解答:
解:A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,
(1)由上面的分析可知,A为C元素,B为O元素,C为Si元素,D为Na元素,
故答案为:C;O;Si; Na;
(2)四种元素中在常温常压下有液态或气态氢化物的为C、O、Si,它们的非金属性:O>C>Si,故氢化物的稳定性为:H2O>CH4>SiH4,
故答案为:H2O>CH4>SiH4;
(3)A与B形成的三原子分子为:CO2,二氧化碳的电子式为: ,将共用电子对换成短线即为结构式,二氧化碳的结构式为:O=C=O;
,将共用电子对换成短线即为结构式,二氧化碳的结构式为:O=C=O;
B与D形成的原子个数比为1:1的化合物为过氧化钠,过氧化钠属于离子化合物,其电子式为: ,
,
故答案为:O=C=O; ;
;
(4)B为O元素,D为Na元素,D2B为Na2O,氧化钠为离子化合物,用电子式表示其形成过程为: ,
,
故答案为: .
.
 ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素,(1)由上面的分析可知,A为C元素,B为O元素,C为Si元素,D为Na元素,
故答案为:C;O;Si; Na;
(2)四种元素中在常温常压下有液态或气态氢化物的为C、O、Si,它们的非金属性:O>C>Si,故氢化物的稳定性为:H2O>CH4>SiH4,
故答案为:H2O>CH4>SiH4;
(3)A与B形成的三原子分子为:CO2,二氧化碳的电子式为:
 ,将共用电子对换成短线即为结构式,二氧化碳的结构式为:O=C=O;
,将共用电子对换成短线即为结构式,二氧化碳的结构式为:O=C=O;B与D形成的原子个数比为1:1的化合物为过氧化钠,过氧化钠属于离子化合物,其电子式为:
 ,
,故答案为:O=C=O;
 ;
;(4)B为O元素,D为Na元素,D2B为Na2O,氧化钠为离子化合物,用电子式表示其形成过程为:
 ,
,故答案为:
 .
.
点评:本题考查元素位置结构性质的关系,题目难度中等,正确推断元素的名称为解答关键,注意根据原子位置关系及半径大小找出其在周期表中的相对位置,试题侧重基础知识的考查,有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在标准状况下,1mol水的体积是22.4L |
| B、1molH2所占的体积一定是22.4L |
| C、在标准状况下,NA个任何分子所占的体积约为22.4L |
| D、在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L |
下列离子方程式书写正确的是( )
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、氢氧化铜加到醋酸溶液中:Cu(OH)2+2H+=Cu2++2H2O |
| C、金属铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、铜跟FeCl3溶液反应:Cu+2Fe3+=Cu2++2Fe2+ |
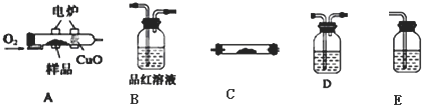
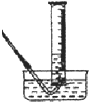
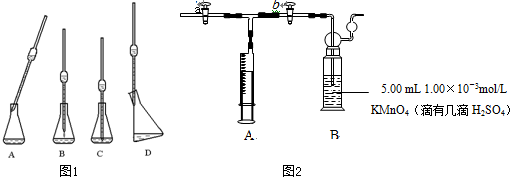
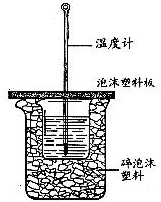 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.