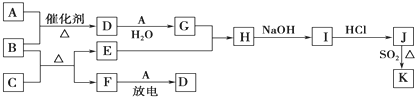
题目内容
已知A、B、C、D是1~18号元素中的四种,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4gA的氧化物恰好与100mL 0.2mol/L的盐酸完全反应,A原子核内质子数与中子数相等.B是地壳中含量最多的金属元素.C得到一个电子后与氩的电子层结构相同,其最高价氧化物的水化物为自然界最强的酸.D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍.
(1)元素C的离子结构示意图为 (填具体元素符号表示,下同),用电子式表示由A、C形成化合物的过程 .
(2)C的最高价氧化物的化学式为 ;元素A、B、C的单原子离子半径由大到小为 .
(3)A的单质可在D的最高价氧化物中燃烧得到一种白色固体和一种黑色固体,试写出其化学方程式 .
(4)C的单质可用于生产漂白粉,该反应的化学方程式为 .
(5)向10mL浓度为1mol/L的B、C两元素形成的化合物的水溶液里逐滴滴入35mL浓度为1mol/L的苛性钠溶液,现象是 .
(1)元素C的离子结构示意图为
(2)C的最高价氧化物的化学式为
(3)A的单质可在D的最高价氧化物中燃烧得到一种白色固体和一种黑色固体,试写出其化学方程式
(4)C的单质可用于生产漂白粉,该反应的化学方程式为
(5)向10mL浓度为1mol/L的B、C两元素形成的化合物的水溶液里逐滴滴入35mL浓度为1mol/L的苛性钠溶液,现象是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=
=40g/mol,所以A的摩尔质量为:40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;
B是地壳中含量最多的金属元素,则B为Al;
C得到一个电子后与氩的电子层结构相同,C原子核外电子数=18-1=17,故C为Cl元素;
D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍,则D为C元素,据此进行解答.
| 0.4g |
| 0.01mol |
B是地壳中含量最多的金属元素,则B为Al;
C得到一个电子后与氩的电子层结构相同,C原子核外电子数=18-1=17,故C为Cl元素;
D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍,则D为C元素,据此进行解答.
解答:
解:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=
=40g/mol,所以A的摩尔质量为:40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B是地壳中含量最多的金属元素,则B为Al;C得到一个电子后与氩的电子层结构相同,C原子核外电子数=18-1=17,故C为Cl元素;D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍,则D为C元素,
(1)C为Cl元素,氯离子的核电荷数为17,核外电子总数为18,氯离子结构示意图为: ;
;
Mg、Cl两元素形成的化合物为MgCl2,MgCl2为离子化合物,用电子式表示的形成过程为: ,
,
故答案为: ;
; ;
;
(2)C为Cl元素,其最高正价为+7价,氯元素的最高价氧化物的化学式为:Cl2O7;
A为Mg,B为Al,C为Cl,离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,则镁离子、氯离子、铝离子半径大小为Cl->Mg2+>Al3+,
故答案为:Cl2O7;Cl->Mg2+>Al3+;
(3)A为Mg元素、D为C元素,C的最高价氧化物为二氧化碳,Mg在二氧化碳中燃烧生成MgO与C,反应的化学方程式为:2Mg+CO2
2MgO+C,
故答案为:2Mg+CO2
2MgO+C;
(4)氯气与石灰乳反应生成氯化钙、次氯酸钙与水,该反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)B为Al,C为Cl元素,二者形成的化合物为氯化铝,
10mL浓度为1mol/L AlCl3水溶液中溶质氯化铝的物质的量为:n(AlCl3)=0.01L×1mol/l=0.01mol,
35mL浓度为1mol/L的苛性钠溶液中,氢氧化钠的物质的量为:n(NaOH)=0.035L×1mol/l=0.035mol,
将NaOH溶液滴入氯化铝溶液中,首先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成氢氧化铝沉淀0.01mol,消耗NaOH0.03mol,剩余NaOH为0.035mol-0.03mol=0.005mol,
然后发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,0.005molNaOH完全反应消耗0.005mol氢氧化铝,沉淀没有完全溶液,
故整个过程现象为:先生成白色沉淀,后白色沉淀部分溶解,
故答案为:先生成白色沉淀,后白色沉淀部分溶解.
| 0.4g |
| 0.01mol |
(1)C为Cl元素,氯离子的核电荷数为17,核外电子总数为18,氯离子结构示意图为:
 ;
;Mg、Cl两元素形成的化合物为MgCl2,MgCl2为离子化合物,用电子式表示的形成过程为:
 ,
,故答案为:
 ;
; ;
;(2)C为Cl元素,其最高正价为+7价,氯元素的最高价氧化物的化学式为:Cl2O7;
A为Mg,B为Al,C为Cl,离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,则镁离子、氯离子、铝离子半径大小为Cl->Mg2+>Al3+,
故答案为:Cl2O7;Cl->Mg2+>Al3+;
(3)A为Mg元素、D为C元素,C的最高价氧化物为二氧化碳,Mg在二氧化碳中燃烧生成MgO与C,反应的化学方程式为:2Mg+CO2
| ||
故答案为:2Mg+CO2
| ||
(4)氯气与石灰乳反应生成氯化钙、次氯酸钙与水,该反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)B为Al,C为Cl元素,二者形成的化合物为氯化铝,
10mL浓度为1mol/L AlCl3水溶液中溶质氯化铝的物质的量为:n(AlCl3)=0.01L×1mol/l=0.01mol,
35mL浓度为1mol/L的苛性钠溶液中,氢氧化钠的物质的量为:n(NaOH)=0.035L×1mol/l=0.035mol,
将NaOH溶液滴入氯化铝溶液中,首先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成氢氧化铝沉淀0.01mol,消耗NaOH0.03mol,剩余NaOH为0.035mol-0.03mol=0.005mol,
然后发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,0.005molNaOH完全反应消耗0.005mol氢氧化铝,沉淀没有完全溶液,
故整个过程现象为:先生成白色沉淀,后白色沉淀部分溶解,
故答案为:先生成白色沉淀,后白色沉淀部分溶解.
点评:本题考查结构性质位置关系应用,题目难度中等,根据所学知识正确推断各元素的名称是解题关键,需要学生熟练掌握元素化合物知识,明确原子结构与元素周期表、元素周期律的关系,其中(5)中注意根据计算结果进行判断.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
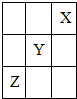 短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )
短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )| A、X,Y,Z中X的单质最稳定 |
| B、Y的氢化物为HY |
| C、Y与水反应能生成HYO |
| D、Z的最高价氧化物的水化物是强酸 |
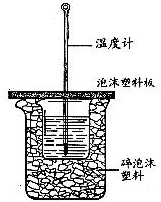 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.回答有关中和反应的问题.