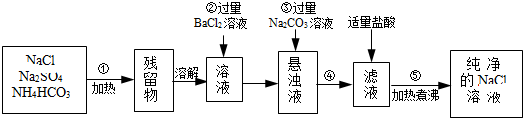
题目内容
6.某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程.回答下列问题: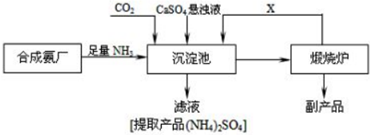
(1)工业合成氨所需氮气来自空气,常用物理方法获;该方法是蒸馏液态空气;原料气氢气中常含有少量CO、CO2、H2S等杂质,必须除去这些杂质的原因是防止催化剂中毒.
(2)工业合成氨反应的化学方程式是N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,该反应在合成塔(填设备名称)中进行.
(3)沉淀池中发生反应的主要方程式是CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,该反应能够发生的原因是生成碳酸钙溶解度小于硫酸钙,有利于反应向正向进行.
(4)上述生产流程中,有关NH3的作用及说明正确的是AB
A.提供制各产品所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
(5)可以循环使用的X是CO2.从绿色化学和资源综合利用的角度说明上述流程的主要优点是该流程中产生的CO2的可以循环利用,得到的产物和副产物都有用,无废弃物产生.
(6)写出硫酸钙的其它一种用途生产水泥石膏.
分析 (1)工业合成氨所需氮气来自空气,常用蒸馏空气的物理方法获得;原料气氢气中常含有少量CO、CO2、H2S等杂质,会引起催化剂中毒,必须除去;
(2)氮气和氢气在高温高压、催化剂条件下反应生成氨气,该反应在合成塔中进行,催化剂为铁触媒;
(3)NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,得以发生的原因是沉淀转化的问题;
(4)根据氨在生产生活中的使用分析;
(5)碳酸钙高温下分解生成氧化钙和二氧化碳,二氧化碳可以循环利用,氧化钙为副产品;从反应原理及可循环利用物质、副产品及是否有污染物生成等角度分析;
(6)硫酸钙可以生产水泥石膏等.
解答 解:(1)工业合成氨所需氮气来自空气,常用蒸馏空气的物理方法获得;原料气氢气中常含有少量CO、CO2、H2S等杂质,会引起催化剂中毒,必须除去,
故答案为:蒸馏液态空气;防止催化剂中毒;
(2)氮气和氢气在高温高压、催化剂条件下反应生成氨气,该反应在合成塔中进行,
故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;合成塔;
(3)NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,得以发生的原因是碳酸钙的溶解性比硫酸钙小,有利于反应向正方向进行,
故答案为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;生成碳酸钙溶解度小于硫酸钙,有利于反应向正向进行;
(4)上述生产流程中,氨气的作用是提供制各产品所需的氮元素,增大CO32-的浓度促进反应发生,不作为催化剂,
故答案为:AB;
(5))CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用,副产品为生石灰,根据反应流程离子,该反应的有利点为:生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成,
故答案为:CO2;该流程中产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生;
(6)硫酸钙的用途可以是生产水泥,石膏等,
故答案为:生产水泥,石膏.
点评 本题考查工业合成氨,题目难度中等,明确合成流程及反应原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力,(2)为易错点,需要从难溶物溶解平均及其转化实质角度考虑.

| A. | 放电过程是电能转化为化学能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时正极极附近溶液的pH变小 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
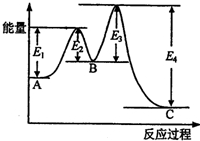 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 稳定性C>A>B | ||
| C. | A与C的能量差为E4 | D. | A?C反应,反应条件一定要加热 |
| A. | 侯氏制碱法是先将CO2通入饱和NaCl溶液后,再通入NH3 | |
| B. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| C. | PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再利用过滤的方法分离PM2.5微粒和可溶性吸附物 | |
| D. | “神十”航天服是由碳化硅陶瓷和碳纤维复合而制成的,它是一种新型无机非金属材料 |
| A. | 0.168L | B. | 0.112L | C. | 0.672L | D. | 0.224L |
| A. | 1,2二氯丙烯 | B. | 2丁炔 | C. | 丙烯 | D. | 1丁烯 |
 有多种同分异构体,其中属于酯类且结构中含苯环的同分异构体有( )
有多种同分异构体,其中属于酯类且结构中含苯环的同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 .
.