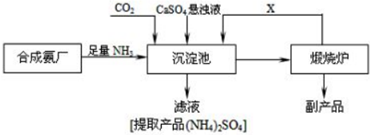
题目内容
1.实验室里需要纯净的氯化钠溶液,但身边只有有杂质硫酸钠、碳酸氢铵的氯化钠固体.某学生设计了提纯方案如图: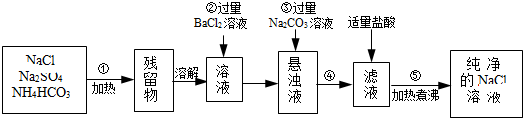
如若该方案可行,请回答下列问题:
(1)操作①中加热固体时,所用到的玻璃和陶瓷仪器有:酒精灯、玻棒、蒸发皿(填名称);此时发生的化学方程式为NH4HCO3 ═NH3↑+CO2↑+H2O.
(2)操作②反应的试剂能否改用硝酸钡溶液?不能(填“能”或“不能”),理由是会使溶液中引入新的杂质离子NO3-.
(3)操作②发生反应的离子方程式为Ba2++SO42-=BaSO4↓.
(4)操作③的目的是除去溶液中过量的Ba2+;操作④的名称是过滤.
(5)操作⑤的目的是除去过量的HCl和溶解在溶液中的CO2;要从制得的纯净氯化钠溶液获得氯化钠晶体,可采用的方法是:蒸发结晶.
分析 (1)蒸发结晶在蒸发皿中进行,铵盐受热易分解;
(2)分离提纯过程中,所加试剂要过量,且不引入新的杂质;
(3)操作②有沉淀产生,是钡离子与硫酸根的反应;
(4)操作③为除掉操作②中引入过量的钡离子.操作④是将操作③产生的沉淀与溶液分离,用过滤;
(5)操作⑤煮沸可除掉易挥发的杂质,氯化钠溶液蒸发结晶就得氯化钠晶体.
解答 解:(1)蒸发结晶是在蒸发皿中进行;铵盐受热易分解,一般是得到氨气和对应的酸,碳酸不稳定分解产生二氧化碳和水,
故答案为:蒸发皿;NH4HCO3 ═NH3↑+CO2↑+H2O;
(2)操作②反应的试剂用氯化钡是考虑到不引入新的杂质,改成硝酸钡就会引入难以除掉的硝酸根离子.
故答案为:不能; 会使溶液中引入新的杂质离子NO3-;
(3)操作②的目的是除掉SO42-,用氯化钡将硫酸根沉淀,是钡离子与硫酸根的反应.
故答案为:Ba2++SO42-=BaSO4↓;
(4)操作③的目的是用碳酸根除掉操作②中引入过量的钡离子.操作④是将操作③产生的沉淀碳酸钡与溶液分离,用过滤.
故答案为:除去溶液中过量的Ba2+; 过滤;
(5)操作⑤是利用盐酸易挥发,将其除掉,同时溶解在溶液中的二氧化碳也被除掉.要从制得的纯净氯化钠溶液获得氯化钠晶体,用蒸发结晶,
故答案为:除去过量的HCl和溶解在溶液中的CO2;蒸发结晶.
点评 本题考查分离提纯中的过滤、蒸发结晶,除杂试剂的选择和除杂的原则以及铵盐的分解,都比较简单.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
15.某有机物A仅有碳、氢、氧三种元素组成,用质谱仪测定如图1,核磁共振氢谱示意图如图2,下列分析不正确的是( )
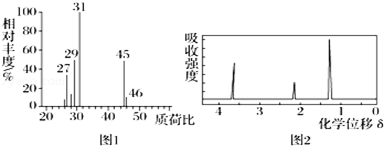

| A. | 由图1可知A的相对分子质量为46 | B. | 由图2可知A分子中有3个氢原子 | ||
| C. | 该有机物的实验式可能为C2H6O | D. | A的结构简式可能为CH3CH2OH |
16.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A. | C与D形成的化合物中只有离子键 | |
| B. | 由C、D、E三元素形成的化合物与A、C、E三元素形成的化合物可能反应 | |
| C. | A、B、C形成的化合物一定不能发生水解反应 | |
| D. | E的氧化物对应的水化物一定为强酸 |
13.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 ( )
| A. | NO2-和${NH}_{2}^{-}$ | B. | H3O+和ClO3- | C. | NO3-和CH3+ | D. | PO43-和SO42-. |
20.下列说法正确的是( )
| A. | 将混有HCl的Cl2通入盛有饱和NaHCO3溶液的洗气瓶除去 | |
| B. | 实验室制取Cl2,浓盐酸起到酸性和还原剂的作用 | |
| C. | 用惰性电极电解饱和食盐水的离子方程式为2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| D. | 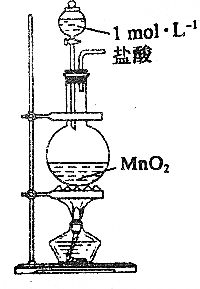 实验室可用图所示装置于制取少量Cl2 |
13.短周期元素A、B、C、D、E原子序数依次增大,其中A、C同主族,B、E同主族,A的最外层电子数与次外层电子数相等,E是太阳能转化为电能的常用材料,则下列说法正确的是( )
| A. | 工业上用电解熔融氧化物的方法制备C单质 | |
| B. | 离子半径:C>D | |
| C. | 熔融它们的单质,所克服的微粒间作用力都相同 | |
| D. | 含D的盐溶液都显酸性 |
11.实验是化学研究的基础,关于下列各实验装置图的叙述中,不正确的是( )
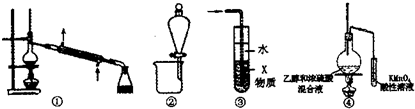

| A. | 装置①可用于石油的分馏 | |
| B. | 装置②可用于苯提取溴水中的Br2 | |
| C. | 装置③中X若为四氯化碳,可用于吸收氨气或氯化氣,并防止倒吸 | |
| D. | 装置④验证乙烯的生成 |