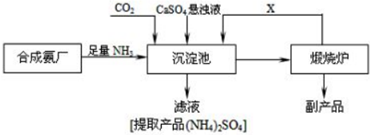
题目内容
1.己知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2.有关该电池的说法正确的是( )| A. | 放电过程是电能转化为化学能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时正极极附近溶液的pH变小 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
分析 该电池放电时,化学能转化为电能,充电时电能转化为化学能,放电时负极反应式为Cd-2e-+2OH-=Cd(OH)2、正极反应式为NiOOH+e-+H2O═Ni(OH)2+OH-,充电时阳极上发生的电极反应式为:Ni(OH)2+OH--e-→NiOOH+H2O,阴极上发生的电极反应式为:Cd(OH)2+2e-═Cd+2OH-,据此分析解答.
解答 解:A.放电时,该装置是原电池,是将化学能能转化为电能的过程,故A错误;
B.充电时,阳极上失电子发生氧化反应,电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O,故B正确;
C.放电时,正极反应式为NiOOH+e-+H2O═Ni(OH)2+OH-,正极上生成氢氧根离子,溶液的pH增大,故C错误;
D,放电时,阴离子向负极移动,则电解质溶液中氢氧根离子向负极Cd移动,故D错误;
故选B.
点评 本题考查原电池和电解池原理,明确各个电极上发生的反应是解本题关键,电极反应式的书写是学习难点,题目难度不大.

练习册系列答案
相关题目
11.常温常压下,50mL三种气态烃的混合物与足量氧气混合点燃爆炸,恢复到原来状况时,体积共缩小100mL,则三种烃可能是( )
| A. | CH4 C2H4 C3H4 | B. | C2H6C3H6 C4H6 | C. | CH4 C2H6 C3H8 | D. | C2H4 C2H6 C3H6 |
12.500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A. | 原混合溶液中c(K+)为2mol•L-1 | B. | 上述电解过程中共转移2mol电子 | ||
| C. | 电解得到铜的物质的量为0.5mol | D. | 电解后溶液中c(H+)为2mol•L-1 |
16.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A. | C与D形成的化合物中只有离子键 | |
| B. | 由C、D、E三元素形成的化合物与A、C、E三元素形成的化合物可能反应 | |
| C. | A、B、C形成的化合物一定不能发生水解反应 | |
| D. | E的氧化物对应的水化物一定为强酸 |
13.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 ( )
| A. | NO2-和${NH}_{2}^{-}$ | B. | H3O+和ClO3- | C. | NO3-和CH3+ | D. | PO43-和SO42-. |
7.下列反应中,符合如图所示能量变化的是( )
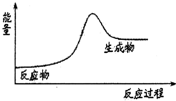

| A. | H2在Cl2中燃烧 | B. | Ba(OH)2•8H2O和NH4Cl固体的反应 | ||
| C. | Na和H2O的反应 | D. | 生石灰溶于水 |
 .
.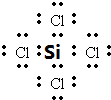 .
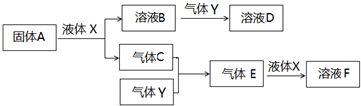
.
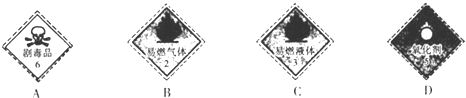
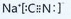 .
.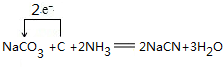 .
.