题目内容
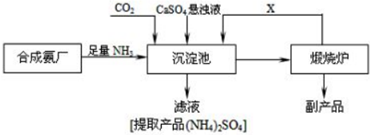
18. 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 稳定性C>A>B | ||
| C. | A与C的能量差为E4 | D. | A?C反应,反应条件一定要加热 |
分析 由图象可知能量B>A>C,化学反应中,反应物总能量大于生成物总能量,则为放热反应的,否则为吸热反应,物质的总能量越高越不稳定,以此解答该题.
解答 解:A.由能量大小关系可知A→B的反应为吸热反应,B→C的反应为放热反应,故A错误;
B.由图象可知能量B>A>C,物质的总能量越高越不稳定,则稳定性C>A>B,故B正确;
C.由图象可知A与C的能量差为E4-E1-(E3-E2),故C错误;
D.由图象只能确定反应吸热或放热,但不能确定是否加热,故D错误.
故选B.
点评 本题考查化学反应与能量变化,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握物质的总能量与反应热的关系,易错点为C,注意把握反应热的计算.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案
相关题目
8.能说明乙烯分子中含有碳碳双键的理由是( )
| A. | 乙烯分子中,C、H原子个数比为1:2 | |
| B. | 乙烯易发生加成反应且1mol乙烯加成时只需1mol溴 | |
| C. | 乙烯能被氧化 | |
| D. | 乙烯完全燃烧生成等物质的量的CO2和H2O |
13.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 ( )
| A. | NO2-和${NH}_{2}^{-}$ | B. | H3O+和ClO3- | C. | NO3-和CH3+ | D. | PO43-和SO42-. |
4.下列叙述中正确的是( )
| A. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| B. | 煤经气化和液化等物理变化可转化为清洁燃料 | |
| C. | 以淀粉为原料可制取乙酸乙酯 | |
| D. | 苯和油脂均不能使酸性髙锰酸钾溶液褪色 |

 .
. .
.
 .
. .
.