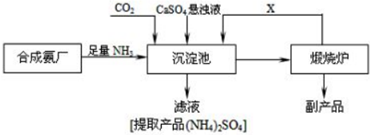
题目内容
18.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3分别为1mol/L和0.5mol/L,取10ml此混合酸,向其中加入过量的铁粉,反应结束后产生的气体在标准状况下的体积是(HNO3被还原成NO)( )| A. | 0.168L | B. | 0.112L | C. | 0.672L | D. | 0.224L |
分析 10mL混合酸中含有:n(H+)=0.01L×2×1mol/L+0.01L×0.5mol/L=0.025mol,n(NO3-)=0.01L×0.5mol/L=0.005mol,由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,以此计算该题.
解答 解:10mL混合酸中含有:n(H+)=0.01L×2×1mol/L+0.01L×0.5mol/L=0.025mol,n(NO3-)=0.01L×0.5mol/L=0.005mol,
由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,则
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
0.005mol 0.02mol 0.005mol
反应后剩余n(H+)=0.025mol-0.02mol=0.005mol,
Fe+2H+=Fe2++H2↑
0.005mol 0.0025mol
所以:n(NO)+n(H2)=0.005mol+0.0025mol=0.0075mol,
V(NO)+V(H2)=0.0075mol×22.4L/mol=0.168L,
故选A.
点评 本题考查混合物的计算,题目难度中等,本题注意铁过量,根据n(H+)、n(NO3-)判断反应的可能性,判断生成气体为NO和H2的混合物,进而计算气体的体积,题目易错.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
12.500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A. | 原混合溶液中c(K+)为2mol•L-1 | B. | 上述电解过程中共转移2mol电子 | ||
| C. | 电解得到铜的物质的量为0.5mol | D. | 电解后溶液中c(H+)为2mol•L-1 |
13.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 ( )
| A. | NO2-和${NH}_{2}^{-}$ | B. | H3O+和ClO3- | C. | NO3-和CH3+ | D. | PO43-和SO42-. |
13.短周期元素A、B、C、D、E原子序数依次增大,其中A、C同主族,B、E同主族,A的最外层电子数与次外层电子数相等,E是太阳能转化为电能的常用材料,则下列说法正确的是( )
| A. | 工业上用电解熔融氧化物的方法制备C单质 | |
| B. | 离子半径:C>D | |
| C. | 熔融它们的单质,所克服的微粒间作用力都相同 | |
| D. | 含D的盐溶液都显酸性 |
7.下列反应中,符合如图所示能量变化的是( )
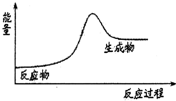

| A. | H2在Cl2中燃烧 | B. | Ba(OH)2•8H2O和NH4Cl固体的反应 | ||
| C. | Na和H2O的反应 | D. | 生石灰溶于水 |
8.下列实验现象与对应结论均正确的是( )
| 选项 | 操 作 | 现象 | 结论 |
| A | 实验1:4mL 0.01mol/L KMnO4酸性溶液+2mL 0.1mol/LH2C2O4溶液+4mL水; 实验2:4mL 0.01mol/L KMnO4酸性溶液+4mL 0.1mol/L H2C2O4溶液+2mL水; 记录褪色时间. | 实验2先褪色 | H2C2O4浓度越大反应速率越快. |
| B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
| C | 向砖红色Ag2CrO4沉淀上滴加 0.1mol/LNaCl溶液 | 沉淀变为黑色 | Ksp(Ag2CrO4)>Ksp(AgCl) |
| D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸未发生反应 |
| A. | A | B. | B | C. | C | D. | D |