题目内容
14.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 20gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 标准状况下,22.4L水中含有共价键数为2NA | |
| D. | 50mL 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A、求出重水和水的物质的量,然后根据重水和H2O中均含10个质子来分析;
B、亚硫酸为弱电解质;
C、标况下水为液态;
D、二氧化锰只能与浓盐酸反应,和稀盐酸不反应.
解答 解:A、20g重水的物质的量和18g水的物质的量均为1mol,而重水和H2O中均含10个质子,故1mol重水和水中均含10NA个质子,故A正确;
B、亚硫酸为弱电解质,不能完全电离,故溶液中的氢离子的个数小于2NA个,故B错误;
C、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和共价键数,故C错误;
D、二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故浓盐酸变稀后反应即停止,故转移的电子数小于0.3NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.下列叙述中,正确的是( )
| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 | |
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| C. | NF3和BF3是中心原子杂化类型相同的极性分子 | |
| D. | 在SiO2晶体中,Si原子与Si-O键数目比为1:4 |
9.一定质量的某有机物和足量的金属钠反应,可得到VaL气体.向等质量该有机物的溶液中加入足量的NaHCO3溶液,可得到VbL气体(不考虑溶于水的气体),已知在同温同压下Va>Vb,则该有机物可能是( )
| A. | HOCH2CHOHCOOH | B. | HO(CH2)2CHO | C. | HOOC-COOH | D. | CH3CH2COOH |
19.下列叙述中,正确的是( )
| A. | 在水溶液中或熔融状态下能导电的化合物是电解质 | |
| B. | 三氧化硫溶于水后,溶液能导电,三氧化硫是电解质 | |
| C. | 硝酸钾在电流作用下电离出钾离子和硝酸根离子 | |
| D. | 溶于水后能电离出氢离子的化合物都是酸 |
2.最近科学家Sutherland等人利用H2S、HCN(氰化氢)和紫外线合成了核酸前体,将探索地球生命起源的研究向前推进了一大步.下列说法不正确的是( )
| A. | 核酸存在于一切生物体中 | B. | 0.05mol•L-1H2S溶液pH=1 | ||
| C. | HCN的结构式为:H-C≡N | D. | HCN和H2S均属于弱电解质 |
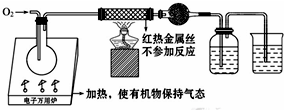 一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示: .
.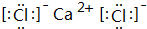 ;
; .
.

 .
.