题目内容
5.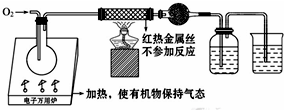 一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18g,澄清石灰水变浑浊后又恰好变澄清.请根据实验回答下列问题:
(1)O2要过量的原因是:把有机物蒸气完全带入反应装置、保证有机物完全燃烧;从反应装置中把H2O(g)和CO2完全赶出.
(2)若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为C8H10,它可能属于BC(填序号).
A.烷烃 B.苯的同系物C.芳香烃 D.烃的衍生物
该物质可能的结构简式为:
 .
.(3)若该有机物分子中含有一个氧原子,则它可能是哪几类物质?请各举一例,填写于如表中:
| 物质种类 | 实例(写结构简式) |
分析 (1)该反应需要通过测量燃烧产物二氧化碳、水的量确定其分子式,所以需要通入过量氧气,确保有机物完全燃烧,且利用氧气将燃烧产物赶出;
(2)根据n=$\frac{V}{{V}_{m}}$计算出该有机物的物质的量,干燥管和洗气瓶共增重18g,根据n=$\frac{m}{M}$计算出水的物质的量,再利用质量守恒定律确定有机物分子中含有H原子数;澄清石灰水吸收二氧化碳,变浑浊后又恰好变澄清,说明反应生成碳酸氢钙,根据氢氧化钙的物质的量计算出消耗二氧化碳的物质的量,再计算出该有机物分子中含有的C原子数,从而确定该有机物的分子式;不含任何官能团,也不含脂环,该有机物可能含有苯环;
(3)结合(2)分析,若该有机物分子中含有一个氧原子,可能为醇、酚、或醚等.
解答 解:(1)试验过程中,为了把有机物蒸气完全带入反应装置,保证有机物完全燃烧,从反应装置中把H2O(g)和CO2完全赶出,所以通入的氧气需要足量,
故答案为:把有机物蒸气完全带入反应装置;保证有机物完全燃烧;从反应装置中把H2O(g)和CO2完全赶出;
(2)标准状况下4.48L气体的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,
无水CuSO4变蓝,干燥管和洗气瓶共增重18g,说明18g为水的质量,则水的物质的量为:$\frac{18g}{18g/mol}$=1mol,该有机物分子中含有H原子数为:$\frac{1mol×2}{0.2mol}$=10,
含0.8mol Ca(OH)2的澄清石灰水变浑浊又变澄清,说明二氧化碳与氢氧化钙反应生成碳酸氢钙,则生成二氧化碳的物质的量为:0.8mol×2=1.6mol,该有机物分子中含有C原子数为:$\frac{1.6mol}{0.2mol}$=8,
该有机物只含C、H元素,则该有机物分子式为:C8H10,该有机物不含任何官能团,但含苯环,则该有机物属于苯的同系物、芳香烃,可能为 ,
,
故答案为:C8H10;B C; ;
;
(3)若该有机物分子中含有一个氧原子,则分子式为C8H10O,可能为醇,如苯乙醇,可能为酚,如乙基苯酚,可能为醚,如苯甲醚等,如表所示: ,
,
故答案为: .
.
点评 本题考查了有机物的推断,为高考常见题型,侧重于学生的分析、计算能力的考查,注意把握分子式的确定方法,题目难度中等,明确质量守恒定律在确定有机物分子式中的应用,注意掌握常见有机物结构、性质及分类方法.

| A. | 同分异构体 | B. | 同一种物质 | C. | 同系物 | D. | 多糖类物质 |
| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 实验②中,混合物过量 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g的混合物全部反应 |
| A. | 至少存在5 种离子 | |
| B. | SO42-、NH4+、Fe3+、一定存在,Cl-、K+、Al3+可能存在 | |
| C. | K+一定存在,Al3+可能存在 | |
| D. | Cl-一定存在,且c(Cl-)≥0.4mol/L |
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
①Na2SO3稀溶液与I2反应的离子方程式是:I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(2)已知:I2+2S2O32-═2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{4.2×1{0}^{2}}{w}$mg/kg.
| A. | 20gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 标准状况下,22.4L水中含有共价键数为2NA | |
| D. | 50mL 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
| A. | 氢氧化钠的水溶液 | B. | 氢氧化钠的醇溶液 | ||
| C. | 浓硫酸、加热 | D. | 铜、加热 |
