题目内容
19.下列叙述中,正确的是( )| A. | 在水溶液中或熔融状态下能导电的化合物是电解质 | |
| B. | 三氧化硫溶于水后,溶液能导电,三氧化硫是电解质 | |
| C. | 硝酸钾在电流作用下电离出钾离子和硝酸根离子 | |
| D. | 溶于水后能电离出氢离子的化合物都是酸 |
分析 A.根据电解质的定义及电解质和导电能力的关系分析判断,在水溶液里或熔融状态下能导电的化合物是电解质;
B.在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质;
C.电离无需通电;
D.水溶液中电离出的阳离子全部是氢离子的化合物为酸,盐溶液中也可以电离出氢离.
解答 解:A.电解质是在水溶液中或熔融状态下能导电的化合物,电解质溶于水或熔融状态能电离出自由移动的离子,所以电解质溶液或熔融态电解质能导电,故A正确;
B.三氧化硫的水溶液能导电,但电离出自由移动离子的是硫酸不是三氧化硫,所以三氧化硫是非电解质,故B错误;
C.硝酸钾在水分子作用下电离出钾离子和硝酸根离子,故C错误;
D.溶于水后能电离出氢离子的化合物不都是酸,如NaHSO4=Na++H++SO42-,故D错误;
故选A.
点评 本题考查了电解质、非电解质的判断、电解质电离的条件,题目难度不大,注意理解电解质、非电解质概念实质.

练习册系列答案
相关题目
10.某溶液可能含有Cl-、SO42-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH 溶液,加热,得到0.02mol 气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到 1.6g 固体;向上述滤液中加足量BaCl2溶液,得到 4.66g 不溶于盐酸的沉淀.由此可知原溶液中( )
| A. | 至少存在5 种离子 | |
| B. | SO42-、NH4+、Fe3+、一定存在,Cl-、K+、Al3+可能存在 | |
| C. | K+一定存在,Al3+可能存在 | |
| D. | Cl-一定存在,且c(Cl-)≥0.4mol/L |
14.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 20gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 标准状况下,22.4L水中含有共价键数为2NA | |
| D. | 50mL 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
9.能说明氯元素的非金属性比硫元素强的事实是( )
①Cl2与H2S溶液发生置换反应
②受热时H2S能分解,HCl则不能
③单质硫可在空气中燃烧,Cl2不能
④HCl是强酸,H2S是弱酸.
①Cl2与H2S溶液发生置换反应
②受热时H2S能分解,HCl则不能
③单质硫可在空气中燃烧,Cl2不能
④HCl是强酸,H2S是弱酸.
| A. | ①④ | B. | ①② | C. | ③④ | D. | ②④ |
6.下列关于有机物的说法正确的是( )
| A. | 乙醛和甲苯都能与溴水反应 | |
| B. | 蛋白质和油脂都属于天然高分子化合物 | |
| C. | 甲烷中混有的乙烯可通过溴的四氯化碳除去 | |
| D. | 苯酚能使酸性高锰酸钾溶液褪色 |
7.一种氢能的制取、贮存及利用如图所示,图示中能量转化方式不涉及( )


| A. | 电能→化学能 | B. | 光能→化学能 | C. | 化学能→电能 | D. | 电能→机械能 |
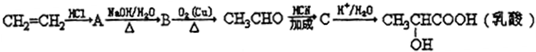
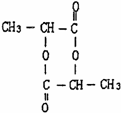 、两分子成链状酯
、两分子成链状酯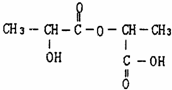 .
.
