题目内容
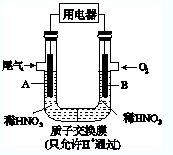 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )| A、电极A表面反应之一为NO2-e-+H2O═NO3-+2H+ |
| B、电极B附近的c(NO3-)增大 |
| C、电解质溶液中电流的方向由B到A,电子的流向与之相反 |
| D、该电池工作时,每转移4 mol电子,生成22.4LO2 |
考点:原电池和电解池的工作原理
专题:
分析:该原电池中,氮氧化物失电子发生氧化反应,电极反应式之一为NO2-e-+H2O=NO3-+2H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,再结合氧气和转移电子之间的关系式计算.
解答:
解:A.该原电池中,通入氮氧化物的电极是负极,负极上失电子发生氧化反应,电极A表面反应之一为NO2-e-+H2O=NO3-+2H+,故A正确;
B.B电极上电极反应式为O2+4e-+4H+=2H2O,有水生成,硝酸根离子不参加反应,所以硝酸根离子的物质的量不变,溶液体积增大,所以硝酸根离子浓度减小,故B错误;
C.电解质溶液中是通过阴阳离子的定性移动形成电流,故C错误;
D.该电池工作时,正极上氧气得电子发生还原反应,温度和压强未知,导致22.4L氧气的物质的量未知,故D错误;
故选A.
B.B电极上电极反应式为O2+4e-+4H+=2H2O,有水生成,硝酸根离子不参加反应,所以硝酸根离子的物质的量不变,溶液体积增大,所以硝酸根离子浓度减小,故B错误;
C.电解质溶液中是通过阴阳离子的定性移动形成电流,故C错误;
D.该电池工作时,正极上氧气得电子发生还原反应,温度和压强未知,导致22.4L氧气的物质的量未知,故D错误;
故选A.
点评:本题考查了原电池原理,涉及电极反应式的书写、离子的移动方向判断等知识点,易错选项是CD,电子不进入溶液中,气体摩尔体积的适用范围及适用条件,为易错点.

练习册系列答案
相关题目
室温下某溶液中水电离出的[H+]=10-12 mol?L-1,则该溶液中一定能大量共存的离子组是( )
| A、Na+ Fe3+ Cl- I- |
| B、Ca2+、K+、Cl-、HCO3- |
| C、Mg2+ Na+ SO42-Cl- |
| D、K+ Na+ SO42-NO3- |
在一定条件下,对于在密闭容器中进行的反应P(g)+Q(g)?R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是( )
| A、P、Q、R、S的浓度相等 |
| B、P、Q、R、S在容器中共存 |
| C、P、Q、R、S的浓度不再变化 |
| D、P、Q的反应速率相等 |
在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
| A、2H2(g)+O2(g)═2H2O(g)△H=-Q1 2H2(g)+O2(g)═2H2O(l)△H=-Q2 | ||||
| B、S(g)+O2(g)═SO2(g)△H=-Q1 S(s)+O2(g)═SO2(g)△H=-Q2 | ||||
C、C(s)+
| ||||
D、H2(g)+Cl2(g)═2HCl(g)△H=-Q1
|
对物质进行分类是为了更好地认识物质的共性.下列分类的依据及分类方法正确的是( )
| A、根据物质能否溶于水,将物质分为易溶物质和难溶物质 |
| B、根据化学反应中是否有单质生成把化学反应分为氧化还原反应和非氧化还原反应 |
| C、根据物质中是否含碳元素,将物质分为无机物和有机物 |
| D、根据酸中是否含有氧元素,将酸分为无氧酸和含氧酸 |
VmL Al2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到4VmL,则稀释后溶液中SO42-的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|