题目内容
等物质的量的CuSO4和NaCl的混合物,完全溶于水,用石墨电极对溶液进行电解,根据电极产物可分为三个阶段.按要求回答下列问题.
(1)第一阶段阴极电极反应式 ,阳极电极反应式 .
(2)第二阶段阴极电极反应式 ,阳极电极反应式 .此阶段酸性明显增强的是 填阳极,阴极).
(3)第三阶段阴极电极反应式 ,阳极电极反应式 .
(1)第一阶段阴极电极反应式
(2)第二阶段阴极电极反应式
(3)第三阶段阴极电极反应式
考点:电解原理
专题:
分析:用惰性电极电解物质的量浓度相等的CuSO4、NaCl混合溶液,电解过程分为:
(1)第一阶段,阳极上氯离子放电、阴极上铜离子放电;
(2)第二阶段:阳极上氢氧离子放电,阴极上铜离子放电;
(3)第三阶段:阳极上氢氧根离子放电,阴极上氢离子放电.
(1)第一阶段,阳极上氯离子放电、阴极上铜离子放电;
(2)第二阶段:阳极上氢氧离子放电,阴极上铜离子放电;
(3)第三阶段:阳极上氢氧根离子放电,阴极上氢离子放电.
解答:
解:用惰性电极电解物质的量浓度相等的CuSO4、NaCl混合溶液,设溶液体积为1L,硫酸铜、氯化钠浓度都为1mol/L,
则n(CuSO4)=n(Cu)=1mol,n(NaCl)=n(Cl-)=1mol,根据转移电子守恒,
(1)第一阶段:阳极上氯离子放电,电极反应为:2Cl--2e-=Cl2↑,阴极上铜离子放电,电极反应为:Cu2++2e-=Cu,当氯离子完全放电时,转移电子的物质的量为1mol,当转移电子的物质的量为1mol时,析出铜的物质的量为0.5mol,还剩0.5mol铜离子,所以电池反应式为2Cl-+Cu2+
Cu+Cl2↑;
故答案为:Cu2++2e-=Cu,2Cl--2e-=Cl2↑;
(2)第二阶段:阴极上铜离子放电,电极反应为:Cu2++2e-=Cu,阳极上氢氧根离子放电,4OH--4e-=2H2O+O2↑当铜离子完全析出前,发生的电池反应式为2Cu2++2H2O
2Cu+O2↑+4H+;阳极附近氢氧根离子浓度减小,氢离子浓度增大,溶液酸性增强;
故答案为:Cu2++2e-=Cu,4OH--4e-=2H2O+O2↑,阳极;
(3)第三阶段:阴极上氢离子放电,电极反应为:2H++2e-=H2↑,阳极上氢氧根离子放电生成氧气,电极反应为:4OH--4e-=2H2O+O2↑,所以发生的电池反应式为2H2O
2H2↑+O2↑;
故答案为:2H++2e-=H2↑,4OH--4e-=2H2O+O2↑.
则n(CuSO4)=n(Cu)=1mol,n(NaCl)=n(Cl-)=1mol,根据转移电子守恒,
(1)第一阶段:阳极上氯离子放电,电极反应为:2Cl--2e-=Cl2↑,阴极上铜离子放电,电极反应为:Cu2++2e-=Cu,当氯离子完全放电时,转移电子的物质的量为1mol,当转移电子的物质的量为1mol时,析出铜的物质的量为0.5mol,还剩0.5mol铜离子,所以电池反应式为2Cl-+Cu2+
| ||
故答案为:Cu2++2e-=Cu,2Cl--2e-=Cl2↑;
(2)第二阶段:阴极上铜离子放电,电极反应为:Cu2++2e-=Cu,阳极上氢氧根离子放电,4OH--4e-=2H2O+O2↑当铜离子完全析出前,发生的电池反应式为2Cu2++2H2O
| ||
故答案为:Cu2++2e-=Cu,4OH--4e-=2H2O+O2↑,阳极;
(3)第三阶段:阴极上氢离子放电,电极反应为:2H++2e-=H2↑,阳极上氢氧根离子放电生成氧气,电极反应为:4OH--4e-=2H2O+O2↑,所以发生的电池反应式为2H2O
| ||
故答案为:2H++2e-=H2↑,4OH--4e-=2H2O+O2↑.
点评:本题考查了电解原理,明确离子放电顺序是解本题关键,结合转移电子相等判断阴阳极上析出的物质,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
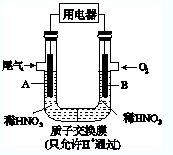 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )| A、电极A表面反应之一为NO2-e-+H2O═NO3-+2H+ |
| B、电极B附近的c(NO3-)增大 |
| C、电解质溶液中电流的方向由B到A,电子的流向与之相反 |
| D、该电池工作时,每转移4 mol电子,生成22.4LO2 |
1 1 |
2 1 |
3 1 |
| A、氢的五种同位素 |
| B、五种氢元素 |
| C、氢的五种核素 |
| D、氢元素的五种不同粒子 |
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它.CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关的推断中错误的是( )
| A、“另一种反应物”一定具有还原性 |
| B、CuH既可做氧化剂也可做还原剂 |
| C、CuH+Cl2═CuCl+HCl(燃烧) |
| D、CuH+HCl═CuCl+H2↑(常温) |
化学与人类生活、社会可持续发展密切相关.下列说法正确的是( )
| A、制作快餐饭盒的可降解“玉米塑料”(主要成分是聚乳酸)是纯净物 |
| B、“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| C、福尔马林可作食品的保鲜剂 |
| D、用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |



 某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答下列问题:
某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,试回答下列问题: