题目内容
室温下某溶液中水电离出的[H+]=10-12 mol?L-1,则该溶液中一定能大量共存的离子组是( )
| A、Na+ Fe3+ Cl- I- |
| B、Ca2+、K+、Cl-、HCO3- |
| C、Mg2+ Na+ SO42-Cl- |
| D、K+ Na+ SO42-NO3- |
考点:离子共存问题
专题:离子反应专题
分析:室温下某溶液中水电离出的[H+]=10-12mol?L-1,该溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.铁离子能够氧化碘离子,铁离子与氢氧根离子反应;
B.碳酸氢根离子既能够与氢离子反应,也能够与氢氧根离子反应;
C.碱性条件下,镁离子与氢氧根离子反应生成氢氧化镁沉淀;
D.四种离子之间不发生反应,都不与氢离子和氢氧根离子反应.
A.铁离子能够氧化碘离子,铁离子与氢氧根离子反应;
B.碳酸氢根离子既能够与氢离子反应,也能够与氢氧根离子反应;
C.碱性条件下,镁离子与氢氧根离子反应生成氢氧化镁沉淀;
D.四种离子之间不发生反应,都不与氢离子和氢氧根离子反应.
解答:
解:水电离出的[H+]=10-12mol?L-1,该溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.Fe3+、I-之间发生氧化还原反应,Fe3+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.HCO3-既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.碱性溶液中,Mg2+与氢氧根离子反应生成氢氧化镁沉淀,在溶液中不能大量共存,故C错误;
D.K+、Na+、SO42-、NO3-离子之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
A.Fe3+、I-之间发生氧化还原反应,Fe3+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.HCO3-既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.碱性溶液中,Mg2+与氢氧根离子反应生成氢氧化镁沉淀,在溶液中不能大量共存,故C错误;
D.K+、Na+、SO42-、NO3-离子之间不反应,都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评:本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
用加热法可以分离的一组物质是( )
| A、氯化铵和消石灰 |
| B、碳酸氢铵和过氧化钠 |
| C、氯化铵和氯化钠 |
| D、氯化铵和碘 |
将足量的NO2和一定量的SO2混合气体通入氯化钡中,产生的沉淀( )
| A、不可能是亚硫酸钡 |
| B、一定是亚硫酸钡 |
| C、一定是硫酸钡 |
| D、一定是亚硫酸钡和硫酸钡 |
在0.1mol/L NH3?H2O 溶液中,下列关系正确的是( )
| A、c(NH3?H2O)>c(OH-)>c(NH4+)>c(H+) |
| B、c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
| C、c(NH3?H2O)>c(NH4+)=c(OH-)>c(H+) |
| D、c(NH3?H2O)>c(NH4+)>c(H+)>c(OH-) |
以惰性电极电解下列电解质溶液(足量),阴、阳两极均产生气体且气体的体积相等的是( )
| A、AgNO3 |
| B、NaCl |
| C、CuCl2 |
| D、Na2SO4 |
下列说法不正确的是( )
| A、浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 |
| B、氧化铝的熔点很高,可用于制造熔融烧碱的坩埚 |
| C、炭具有还原性,高温下能将二氧化硅还原为硅 |
| D、饱和氯水既有酸性又有漂白性,加入NaHCO3漂白性增强 |
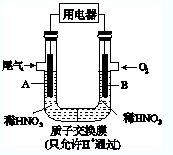 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )| A、电极A表面反应之一为NO2-e-+H2O═NO3-+2H+ |
| B、电极B附近的c(NO3-)增大 |
| C、电解质溶液中电流的方向由B到A,电子的流向与之相反 |
| D、该电池工作时,每转移4 mol电子,生成22.4LO2 |

