题目内容
在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
| A、2H2(g)+O2(g)═2H2O(g)△H=-Q1 2H2(g)+O2(g)═2H2O(l)△H=-Q2 | ||||
| B、S(g)+O2(g)═SO2(g)△H=-Q1 S(s)+O2(g)═SO2(g)△H=-Q2 | ||||
C、C(s)+
| ||||
D、H2(g)+Cl2(g)═2HCl(g)△H=-Q1
|
考点:反应热的大小比较
专题:化学反应中的能量变化
分析:选项中的反应都为放热反应,由热化学方程式可知Q越大,放出的热量越多,物质反应的越彻底,参加反应的物质的量越多,放出的热量越多,物质的聚集状态不同,Q不同,以此解答该题.
解答:
解:A.H2O(气)→H2O(液)为放热过程,则Q1<Q2,故A正确;
B.S(固)→S(气)为吸热过程,则Q2<Q1,故B错误;
C.因CO(气)→CO2(气)为放热过程,后者反应比较彻底,放出的热量更多,则Q2>Q1,故C正确;
D.参加反应的物质的量越多,放出的热量越多,则Q2<Q1,故D错误.
故选AC.
B.S(固)→S(气)为吸热过程,则Q2<Q1,故B错误;
C.因CO(气)→CO2(气)为放热过程,后者反应比较彻底,放出的热量更多,则Q2>Q1,故C正确;
D.参加反应的物质的量越多,放出的热量越多,则Q2<Q1,故D错误.
故选AC.
点评:本题考查反应热的大小比较,题目难度中等,本题注意比较反应热的角度,化学反应中,反应的程度、物质的量以及物质的聚集状态不同,反应放出或吸收的热量是不同的.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
将足量的NO2和一定量的SO2混合气体通入氯化钡中,产生的沉淀( )
| A、不可能是亚硫酸钡 |
| B、一定是亚硫酸钡 |
| C、一定是硫酸钡 |
| D、一定是亚硫酸钡和硫酸钡 |
对于化学反应3W(g)+2X(g)?4Y(g)+3Z(g),下列反应速率关系中错误的是( )
| A、2υ(W)=3υ(X) |
| B、2υ(X)=3υ(Z) |
| C、2υ(Y)=4υ(X) |
| D、3υ(Y)=4υ(Z) |
下列实验现象与氧化还原反应无关的是( )
| A、点燃酒精灯,灯芯燃烧产生黄色火焰 |
| B、碳与氧化铜共热,黑色固体变成红色 |
| C、往澄清石灰水中吹气,石灰水变混浊 |
| D、稀硫酸中加入锌粒,有无色气泡从溶液中逸出 |
放热反应CO(g)+H2O(g)?CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol?L-1,其平衡常数为K1.升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
| A、K2和K1的单位均为mol?L-1 |
| B、K2>K1 |
| C、c2(CO)=c2(H2O) |
| D、c1(CO)>c2(CO) |
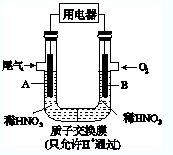 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )| A、电极A表面反应之一为NO2-e-+H2O═NO3-+2H+ |
| B、电极B附近的c(NO3-)增大 |
| C、电解质溶液中电流的方向由B到A,电子的流向与之相反 |
| D、该电池工作时,每转移4 mol电子,生成22.4LO2 |
对于某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,一定有Ag+ |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变红,一定有NH4+ |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,不一定有Ba2+ |