题目内容
VmL Al2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到4VmL,则稀释后溶液中SO42-的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据n=
计算出铝离子的物质的量,再根据化学式计算出硫酸根离子的物质的量,最后根据稀释过程中溶质的物质的量不变计算出稀释后溶液中SO42-的物质的量浓度.
| m |
| M |
解答:
解:ag铝离子的物质的量为:n(Al3+)=
=
mol,
则VmL硫酸铝溶液中含有硫酸根离子的物质的量为:n(SO42-)=
×n(Al3+)=
mol×
=
mol,
V/4mL溶液中含有硫酸根离子的物质的量为:
mol×
=
mol,
溶液稀释过程中溶质的物质的量不变,则稀释后溶液中硫酸根离子的浓度为:c(SO42-)=
=
mol/L,
故选C.
| ag |
| 27g/mol |
| a |
| 27 |
则VmL硫酸铝溶液中含有硫酸根离子的物质的量为:n(SO42-)=
| 3 |
| 2 |
| a |
| 27 |
| 3 |
| 2 |
| a |
| 18 |
V/4mL溶液中含有硫酸根离子的物质的量为:
| a |
| 18 |
| ||
| VmL |
| a |
| 72 |
溶液稀释过程中溶质的物质的量不变,则稀释后溶液中硫酸根离子的浓度为:c(SO42-)=
| ||
| 4V×10-3L |
| 125a |
| 36 |
故选C.
点评:本题考查了物质的量浓度的计算,题目难度中等,明确离子与化学式之间的关系为解答关键,注意掌握物质的量浓度的概念及计算方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
下列说法不正确的是( )
| A、浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 |
| B、氧化铝的熔点很高,可用于制造熔融烧碱的坩埚 |
| C、炭具有还原性,高温下能将二氧化硅还原为硅 |
| D、饱和氯水既有酸性又有漂白性,加入NaHCO3漂白性增强 |
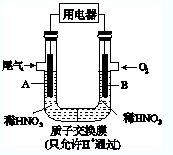 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )| A、电极A表面反应之一为NO2-e-+H2O═NO3-+2H+ |
| B、电极B附近的c(NO3-)增大 |
| C、电解质溶液中电流的方向由B到A,电子的流向与之相反 |
| D、该电池工作时,每转移4 mol电子,生成22.4LO2 |
对于某些离子的检验及结论一定正确的是( )
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,一定有Ag+ |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变红,一定有NH4+ |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,不一定有Ba2+ |
1 1 |
2 1 |
3 1 |
| A、氢的五种同位素 |
| B、五种氢元素 |
| C、氢的五种核素 |
| D、氢元素的五种不同粒子 |
化学与人类生活、社会可持续发展密切相关.下列说法正确的是( )
| A、制作快餐饭盒的可降解“玉米塑料”(主要成分是聚乳酸)是纯净物 |
| B、“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| C、福尔马林可作食品的保鲜剂 |
| D、用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
 标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解.
标准状况,体积相同的四支试管中分别盛满Cl2、NH3、SO2和NO2,分别倒立在盛有足量水的水槽中(假设进入试管的液体不扩散),光照充分溶解.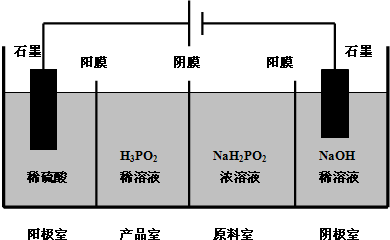 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题: